2. 天津市儿童医院普外科(天津市,300134);3.天津市儿童医院病理科(天津市,300134);
3. Graduate School, Tianjin Medical University, Tianjin 300070, China
2. Department of Pediatrics, Tianjin Children's Hospital, Tianjin Institute of Pediatrics, Tianjin 300134, China;
3. Department of Pathology, Tianjin Children's Hospital, Tianjin 300134, China
胆道闭锁(biliary atresia, BA)是一种以肝内外胆管进行性炎症、纤维性梗阻、肝内胆汁淤积及进行性肝纤维化为主要特征的婴幼儿肝胆疾病[1]。有研究显示自体肝20年生存率不足20%,30年生存率仅10%[2, 3]。Obayashi等[4]发现胆道闭锁自体肝生存时间与胆管反应程度有关,而胆管反应(ductular reaction, DR)的主要原理是肝干细胞或肝原始祖细胞分化为CK7阳性细胞谱系后,CK7可作为肝干细胞分化后中间肝细胞和胆管上皮细胞的标记抗体[5-6]。与胆管反应相关的生物标志物中,CK19的表达能够反应胆管细胞的增生情况,CD56和EpCAM作为不成熟胆管上皮细胞的标志物[7-8],同样可用于胆管反应的临床监测。本研究旨在探讨自体肝生存时间与Kasai手术时肝活检组织中胆管反应的关系,分析胆管增生细胞的来源及性质,为BA患儿的预后评估提供病理学证据。
材料与方法 一、标本来源与分组以2012年1月至2012年12月经天津市儿童医院确诊为胆道闭锁并行Kasai手术的患儿为研究对象,主刀医生为同一高年资主任医师,按照Kasai手术后自体肝生存时间将BA患儿分为两组:自体肝生存时间超过5年,且长期随访未出现消化道出血、严重腹水、反复胆管炎、肝功能失代偿等的10例BA患儿为预后良好组(BA-A组),其中男4例,女6例,手术时日龄为(61.00±3.59)d。1年内死亡或行肝移植的10例为预后不良组(BA-B组),其中男3例,女7例,手术时日龄为(61.90±2.42)d,两组手术时日龄无统计学差异(P>0.05)。同期收集本院收治的胆总管囊肿患儿10例(CC组),其中男6例,女4例,手术时月龄为(36.60±11.8)m;胆汁淤积症患儿10例(CS组),其中男7例,女3例,手术时日龄为(61.00±3.23)d;另选取非肝胆疾病且年龄 < 24个月尸检病例5例,其中男3例,女2例,患儿死亡时月龄为(12.20±6.42)个月。
本研究经天津市儿童医院伦理委员会讨论通过。
二、主要试剂与仪器兔抗人CK7、CK19、CD56、EpCAM单克隆抗体购自北京中杉金桥生物技术有限公司;二抗为辣根酶标记的山羊抗兔/小鼠IgG聚合物与DAB(3, 3'-diaminobenzidine,3, 3-二氨基联苯胺)显色试剂盒,均购自北京博奥生物技术有限公司;ImagePro Plus 6.0自动定量分析系统购自美国Media Cybernetics公司。
三、实验方法1.肝组织标本处理:术中取BA、CC、CS患儿肝右叶前缘组织,经10%福尔马林溶液固定,8~24 h后经石蜡包埋储存,尸检肝组织来源于本院病理科已包埋的蜡块,所有标本处理过程均于同一实验条件下完成。
2. HE染色:病理切片经二甲苯脱蜡,梯度乙醇水洗,浸染苏木素5 min,经酸化伊红乙醇液浸染2 min,梯度乙醇脱水,透明剂浸泡至透明,中性树胶封片等一系列操作。在光学显微镜下观察肝组织细胞形态、胆管增生程度、肝纤维化程度、有无胆栓、炎症细胞浸润程度等。
3.免疫组化染色:病理切片脱蜡至水,枸橼酸盐缓冲液进行抗原修复15 min,冷却至室温,PBS缓冲液冲洗3次,于3% H2O2 37℃中孵育10 min,再用PBS冲洗3次,滴加一抗(CK7、CK19、CD56、EpCAM),于冰箱4℃过夜,次日取出置于室温30 min,PBS冲洗3次,加二抗于37℃下孵育30 min,PBS冲洗3次,经DAB显色5~10 min,镜下观察染色情况,充分水洗,苏木素液染核,脱水、透明、中性树胶封片。
四、病理学评分指标1.肝纤维化程度分级:采用METAVIR纤维化分级(0~4)标准。F0:无纤维化;F1:肝汇管区轻度纤维化;F2:邻近汇管区轻度桥接纤维化;F3:伸向邻近汇管区重度桥接纤维化;F4:肝硬化、假小叶形成[9]。
2.胆管增生程度分级:随机选取5个不同汇管区的视野,计数胆管数量,取平均值为最终结果。增生程度共分为4级,平均每个视野小于5个增生胆管判定为0级(无增生);平均每个视野5~9个增生胆管判定为1级(轻度增生);平均每个视野≥10个增生胆管判定为2级(中度增生);平均每个视野增生胆管>10个的基础上合并增生胆管形态扭曲异常、细小等表现,判定为3级(重度增生)[10]。
3.胆栓分级:1级:汇管区无胆栓;2级:仅部分汇管区的部分胆管存在胆栓;3级:所有汇管区的部分胆管存在胆栓;4级:几乎所有汇管区的全部小胆管均存在胆栓[11]。
4.炎症细胞浸润程度分级:观察汇管区细胞核总数(T)及炎症细胞数目(N),并据其计算分级炎症浸润程度(I=N/T×100%)。炎症细胞浸润程度:1级为Ⅰ < 25%;2级为25%≤Ⅰ < 50%;3级为50%≤Ⅰ < 75%;4级为Ⅰ≥75%。
说明:肝纤维化程度、胆管增生程度、胆栓及炎症细胞浸润程度的分级计分规则为:1级计1分,2级计2分,3级计3分,4级计4分。
五、免疫组化结果1.定性分析:根据染色强度分为阴性(无棕黄色)、弱阳性(淡棕黄色)、阳性(棕黄色)、强阳性(棕褐色)。
2.半定量分析:根据肝组织切片内阳性细胞总光密度值/阳性细胞所占面积求得平均光密度值(AOD)。每张切片内取任意5个视野,用同一计算机成像系统留取相同倍数的镜下图片,采用IPP 6.0计算CK7、CK19、CD56、EpCAM蛋白的AOD。
六、统计学方法采用SPSS 22.0进行统计分析,正态分布的计量资料用(x ±s)表示,两组间计量资料比较依据数据是否服从正态分布分别采用t检验或秩和检验,多组间计量资料比较采用方差分析(方差齐采用Bonferroni法,方差不齐采用Tamhane法);率的比较采用R×C列联表资料的χ2检验,组间两两比较采用Bonferroni法进行显著性水平校正;非正态分布的计量资料用中位数及四分位数[M(P25~P75)]表示,多组间比较采用Kruskal-Wallis H检验,组间多重比较采用Bonferroni法进行显著性水平校正。以P<0.05为差异有统计学意义。
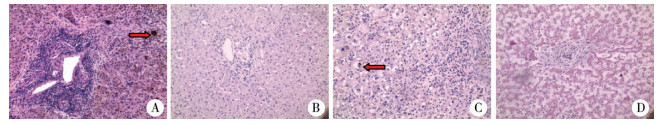
结 果 一、HE染色胆道闭锁预后良好组与预后不良组HE染色镜下共同病理特点包括:汇管区增宽,胆管增生,纤维组织增生、桥接纤维化现象普遍,部分患儿可见假小叶形成,伴炎症细胞浸润,偶可见胆栓和肝细胞巨细胞变(图 1A)。胆总管囊肿镜下肝小叶结构存在,个别汇管区稍增宽,胆管及纤维组织增生不明显,伴少量炎症细胞浸润(图 1B)。胆汁淤积症镜下肝小叶结构存在,毛细胆管可见胆栓,个别汇管区稍增宽,胆管及纤维组织增生不明显,伴少量炎症细胞浸润(图 1C)。尸检镜下肝小叶结构存在,伴少量炎症细胞浸润(图 1D)。
|
Download:
|
| 图 1 A.胆道闭锁HE染色,箭头所指为胆栓(×100);B.胆总管囊肿HE染色(×100);C.胆汁淤积症HE染色,箭头所指为胆栓(×100);D.尸检HE染色(×100) Fig. 1 A.BA for HE staining, arrow indicated biliary plug (×100); B.Choledochal cyst for HE staining (×100); C.Cholestasis for HE staining, arrow indicated biliary plug (×100); D.Autopsy for HE staining (×100) | |
胆道闭锁(BA)、胆总管囊肿(CC)、胆汁淤积症(CS)及尸检对照组肝纤维化程度、胆管增生、胆栓、汇管区炎症细胞浸润程度的评分结果见表 1。4组患儿肝纤维化、胆管增生及胆栓评分比较,差异有统计学意义(H=24.208,P < 0.05;H=39.779,P < 0.05;H=23.119,P < 0.05),除CS组胆栓分级与BA组两两比较差异无统计学意义(P>0.05)外,其余组间两两比较,差异均有统计学意义(P < 0.05);4组患儿汇管区炎症细胞浸润程度评分比较,差异均无统计学意义(H=5.812,P>0.05)。
|
|
表 1 BA、CC、CS及尸检组肝脏病理学评分结果M(P25~P75) Table 1 Hepatic pathological scores of BA, CC, CS and autopsy groups M(P25~P75) |
胆道闭锁预后良好组(BA-A)与预后不良组(BA-B)肝纤维化程度、胆管增生、胆栓、汇管区炎症细胞浸润程度的评分结果对比见表 2。2组患儿肝纤维化、胆管增生、胆栓及汇管区炎症细胞浸润程度的评分差异均无统计学意义(P>0.05)。
|
|
表 2 不同预后BA患儿的肝脏病理学评分结果M(P25~P75) Table 2 Hepatic pathological score in BA children with different prognoses M(P25~P75) |
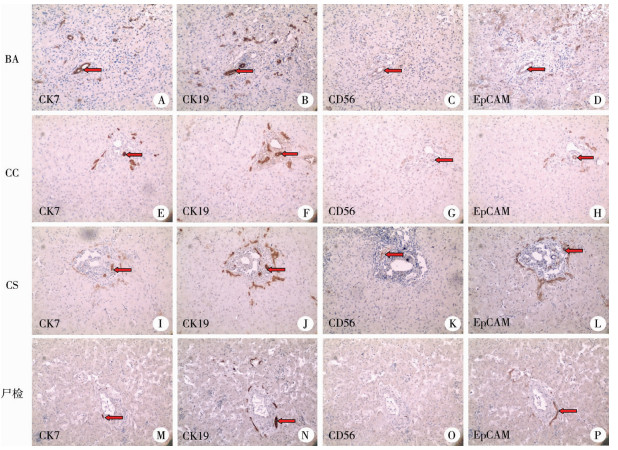
CK7蛋白:BA组和CC组汇管区胆管上皮细胞胞质中均呈强阳性表达,但BA组表达强度更高;CS组和尸检组汇管区胆管上皮细胞胞质中呈弱阳性表达(图 2A、2E、2I、2M)。
|
Download:
|
| 图 2 4组免疫组化染色共位图(×100)图A至图D分别为胆道闭锁患儿CK7、CK19、CD56、EpCAM四种抗体的免疫组化结果;图E至图H分别为胆总管囊肿患儿CK7、CK19、CD56、EpCAM四种抗体的免疫组化结果;图I至图L分别为胆汁淤积症患儿CK7、CK19、CD56、EpCAM四种抗体的免疫组化结果;图M至图P分别为尸检患儿CK7、CK19、CD56、EpCAM四种抗体的免疫组化结果 Fig. 2 Immunohistochemical staining in all groups (×100) A-D.were immunohistochemical results of CK7, CK19, CD56 and EpCAM antibodies in BA children; E-H the immunohistochemical results of CK7, CK19, CD56 and EpCAM antibodies in choledochocele children respectively; I-L immunohistochemical results of CK7, CK19, CD56 and EpCAM antibodies in cholestatic children; M-P immunohistochemical results of CK7, CK19, CD56 and EpCAM antibodies in children with autopsy | |
CK19蛋白:BA、CC、CS和尸检组汇管区胆管上皮细胞胞质中均呈强阳性表达,且表达强度较CK7更高(图 2B、2F、2J、2N)。
CD56蛋白:BA组中75%(15/20)的患儿汇管区胆管上皮细胞胞质中呈弱阳性表达,预后良好组与预后不良组发生CD56表达的患儿比例无统计学差异(7/10 vs.8/10,P>0.05);CC组、CS组和尸检组偶见汇管区胆管上皮细胞中弱阳性表达(图 2C、2G、2K、2O)。
EpCAM蛋白:BA组、CC组、CS组和尸检组汇管区胆管上皮细胞胞质中均呈阳性表达,但BA组表达更显著(图 2D、2H、2L、2P)。
四、免疫组化半定量结果CK7、CK19、CD56和EpCAM在BA、CC、CS及尸检对照组肝组织中表达量比较,差异有统计学意义(F=111.184,P < 0.05;F=1064.972,P < 0.05;F=79.054,P < 0.05;F=53.858,P < 0.05),见表 3。BA预后良好组CK7、CD56、EpCAM表达量显著低于BA预后不良组,差异有统计学意义(t=12.686,P < 0.05;t=9.517,P < 0.05;t=5.232,P < 0.05),但CK19蛋白表达量两组间差异无统计学意义(t=2.115,P>0.05),详见表 4。
|
|
表 3 四组患儿肝组织中CK7、CK19、CD56和EpCAM蛋白表达结果(x±s) Table 3 Comparing the expression levels of CK7, CK19, CD56 and EpCAM in liver tissues of four groups(x±s) |
|
|
表 4 不同预后BA患儿肝组织中CK7、CK19、CD56和EpCAM蛋白表达结果(x±s) Table 4 The expressions of CK7, CK19, CD56 and EpCAM protein in liver tissues of BA children with different prognoses(x±s) |
影响Kasai手术后自体肝生存时间的因素较多,主要包括Kasai手术日龄、BA分型、是否伴发先天性畸形及行Kasai手术时肝脏病理特征(肝纤维化程度、胆管反应)等[12-17]。有研究显示BA患儿肝组织病理学评分可较为全面地评价BA患儿Kasai手术时肝脏受损严重程度。胆管反应指肝干细胞或肝原始祖细胞分化为CK7阳性细胞谱系,最终形成不成熟的微胆管[5, 16],包括胆管增生、原始肝细胞的激活和中间肝胆细胞的出现等[20]。而BA胆管反应时伴有大量胆管细胞增生,增生胆管细胞以不成熟胆管上皮细胞为主,不成熟胆管上皮细胞短时间内的迅速增生可能影响自体肝生存[7]。但增生胆管细胞的性质和来源仍不清楚,因此应进一步明确自体肝生存与Kasai手术时肝活检组织中胆管反应的关系。
一、自体肝生存与肝病理学评分的关系本研究发现BA组、CC组、CS组及尸检组患儿肝纤维化、胆管增生及胆栓的评分差异均有统计学意义,其中BA组患儿肝纤维化程度重,胆管增生明显,且多伴胆栓。4组患儿肝组织病理学评分结果证明BA组患儿病理学评分较高,这提示病理学评分可作为BA与其他梗阻性黄疸患儿的鉴别诊断方法。
患儿在接受Kasai手术时,肝纤维化程度是影响BA术后自体肝生存时间的一个重要因素,但本研究预后良好组与预后不良组肝纤维化程度比较,差异无统计学意义。Obayashi等[4]认为BDP(汇管区胆管数量/汇管区测量面积)比值可作为胆道闭锁Kasai手术后自体肝生存时间的预测指标,该值的增高提示胆管反应时胆管数量显著增加,由此推测胆管增生可能与自体肝生存时间有关。但本研究预后良好组与预后不良组BA患儿的胆管增生分级无明显差异,可能是因为本研究中预后良好组与预后不良组BA患儿接受手术时日龄均在60 d左右,胆管增生程度均较轻;免疫组化CK19染色AOD值两组无差异,说明本研究中预后良好组与预后不良组的胆管增生情况基本无差异。
二、自体肝生存与胆管反应相关蛋白表达的关系角蛋白(cytokeratins, CK)是中间丝基因家族编码的一组复合产物,可分为酸性和中—碱性亚族。其中CK7属于中—碱性亚族,CK19属于酸性亚族。CK7可作为肝干细胞分化后中间肝细胞和胆管上皮细胞的标记抗体[6];CK19则是胆管上皮细胞的经典标志物,能够直接反应胆管细胞的增生情况。CD56是神经细胞粘附分子的一种同型异构体,EpCAM是一种跨膜糖蛋白,有研究显示二者均可作为不成熟胆管上皮细胞的标志物[7-8]。据报道BA患儿肝移植时肝组织中CK7的表达量高于Kasai手术时,说明BA患儿病情较重时胆管反应更显著[21]。本研究中,BA患儿CK7蛋白表达量高于其他梗阻性疾病组和尸检组,预后不良组CK7蛋白表达量高于预后良好组。说明肝活检组织中CK7蛋白表达情况或许可作为自体肝生存时间的一个预测指标。本研究中CK19作为胆管上皮细胞的经典标志物,在所有胆管细胞中均呈强阳性表达。CK19蛋白在BA组的表达量明显高于其他各组,但预后良好组与预后不良组之间表达量无统计学差异,说明CK19可作为胆管细胞的标记抗体,反应胆管增生情况,但与自体肝生存时间的相关性可能不大。
通常情况下,正常成熟的胆管上皮细胞不表达CD56,而在某些引起胆管反应的疾病中,新生的胆管上皮细胞可表达CD56[22]。有研究显示,胆管上皮细胞越成熟,CD56的表达量越低[7]。CD56作为不成熟的胆管上皮细胞标志物,多表达于BA患儿肝组织紊乱增生的胆管上皮细胞中,且BA预后不良组表达量明显高于预后良好组,说明CD56的表达也可能与自体肝生存时间相关。
EpCAM在肝脏发育过程中,也是肝干细胞最早表达的标志物之一,在胚胎发育第8周即可见大量EpCAM阳性的肝干细胞[23]。EpCAM在肝干细胞分化过程中呈动态表达:分化为不成熟肝细胞时可出现EpCAM的表达;分化为成熟肝细胞时,则完全不表达EpCAM[24]。慕永平等[25]把EpCAM作为肝祖细胞的标志物,认为肝祖细胞参与了胆管反应的病理过程,是增殖胆管细胞的主要来源。本研究EpCAM蛋白在BA组的表达量显著高于其他3组,且BA预后不良组的表达量显著高于预后良好组。说明Kasai手术肝活检胆管反应EpCAM的表达也可能与自体肝生存相关。但EpCAM表达量明显高于CD56,这可能是因为CD56仅在胆管反应初期表达,随着胆管上皮细胞的成熟,表达量下降,而EpCAM蛋白表达于所有成熟之前的胆管上皮细胞,故表达量更高。
综上所述,肝组织病理学评分、肝纤维化程度、胆管增生程度等可作为BA与其他黄疸患儿的鉴别诊断依据。BA自体肝生存时间也可能与Kasai手术时肝组织胆管反应相关,但受样本选取的影响,本研究尚未发现自体肝生存与胆管增生的相关性,后期可考虑补充样本作进一步验证。
| 1 |
Asai A, Miethke A, Bezerra JA, et al. Pathogenesis of biliary atresia:defining biology to understand clinical phenotypes[J]. Nat Rev Gastroenterol Hepatol, 2015, 12(6): 342-352. DOI:10.1038/nrgastro.2015.74. |
| 2 |
Lykavieris P, Chardot C, Sokhn M, et al. Outcome in adulthood of biliary atresia:a study of 63 patients who survived for over 20 years with their native liver[J]. Hepatology, 2005, 41(2): 366-371. DOI:10.1002/hep.20547. |
| 3 |
Howard ER, MacLean G, Nio M, et al. Survival patterns in biliary atresia and comparison of quality of life of long-term survivors in Japan and England[J]. J Pediatr Surg, 2001, 36(6): 892-897. DOI:10.1053/jpsu.2001.23965. |
| 4 |
Obayashi J, Kawaguchi K, Manabe S, et al. Prognostic factors indicating survival with native liver after Kasai procedure for biliary atresia[J]. Pediatr Surg Int, 2017, 33(10): 1047-1052. DOI:10.1007/s00383-017-4135-y. |
| 5 |
Kuo FY, Huang CC, Chen CL, et al. Immunohistochemical characterization of the regenerative compartment in biliary atresia:a comparison between Kasai procedure and transplant cases[J]. Hum Pathol, 2015, 46(11): 1633-1639. DOI:10.1016/j.humpath.2015.07.003. |
| 6 |
Paku S, Dezso K, Kopper L, et al. Immunohistochemical analysis of cytokeratin 7 expression in resting and proliferating biliary structures of rat liver[J]. Hepatology, 2005, 42(4): 863-870. DOI:10.1002/hep.20858. |
| 7 |
Zhang RZ, Yu JK, Peng J, et al. Role of CD56-expressing immature biliary epithelial cells in biliary atresia[J]. World J Gastroenterol, 2016, 22(8): 2545-2557. DOI:10.3748/wjg.v22.i8.2545. |
| 8 |
曾信豪, 林泽锋, 张红, 等. EpCAM阳性的不成熟胆道上皮细胞促进胆道闭锁肝纤维化的研究[J]. 中华小儿外科杂志, 2016, 37(3): 201-205. DOI:10.3760/cma.j.issn.0253-3006.2016.03.009. Zeng XH, Lin ZF, Zhang H, et al. Induction of liver fibrosis by EpCAM positive immature biliary epithelial cells in biliary atresia[J]. Chin J Pediatr Surg, 2016, 37(3): 201-205. DOI:10.3760/cma.j.issn.0253-3006.2016.03.009. |
| 9 |
Bedossa P, Poynard T. An algorithm for the grading of activity in chronic hepatitis C.The METAVIR Cooperative Study Group[J]. Hepatology, 1996, 24(2): 289-293. DOI:10.1002/hep.510240201. |
| 10 |
Lee WS, Looi LM. Usefulness of a scoring system in the interpretation of histology in neonatal cholestasis[J]. World Journal of Gastroenterology, 2009, 15(42): 5326-5333. DOI:10.3748/wjg.15.5326. |
| 11 |
刘钧澄, 李桂生, 钟思陶, 等. 胆道闭锁葛西手术后肝脏病理变化[J]. 中华小儿外科杂志, 1994, 15(6): 332-334. Liu JC, Li GS, Zhong ST, et al. Pathological changes of liver after Kasai operation for biliary atresia[J]. Chin J Pediatr Surg, 1994, 15(6): 332-334. |
| 12 |
Song Z, Dong R, Shen Z, et al. Surgical outcome and etiologic heterogeneity of infants with biliary atresia who received Kasai operation less than 60 days after birth:A retrospective study[J]. Medicine (Baltimore), 2017, 96(26): e7267. DOI:10.1097/MD.0000000000007267. |
| 13 |
余晨, 詹江华, 高伟, 等. 胆道闭锁Kasai术后肝移植患儿不同自体肝生存的临床与病理分析[J]. 临床小儿外科杂志, 2017, 16(6): 552-558. DOI:10.3969/j.issn.1671-6353.2017.06.007. Yu C, Zhan JH, Gao W, et al. Clinicopathological analysis with different native liver survivals for biliary atresia after Kasai[J]. J Clin Ped Sur, 2017, 16(6): 552-558. DOI:10.3969/j.issn.1671-6353.2017.06.007. |
| 14 |
Kelay A, Davenport M. Long-term outlook in biliary atresia[J]. Semin Pediatr Surg, 2017, 26(5): 295-300. DOI:10.1053/j.sempedsurg.2017.09.003. |
| 15 |
de Vries W, de Langen ZJ, Groen H, et al. Biliary atresia in the Netherlands:outcome of patients diagnosed between 1987 and 2008[J]. J Pediatr, 2012, 60(4): 638-644. DOI:10.1016/j.jpeds.2011.09.061. |
| 16 |
Russo P, Magee JC, Anders RA, et al. Key Histopathologic features of liver biopsies that distinguish biliary atresia from other causes of infantile cholestasis and their correlation with outcome:a multicenter study[J]. Am J Surg Pathol, 2016, 40(12): 1601-1615. DOI:10.1097/PAS.0000000000000755. |
| 17 |
Obayashi J, Tanaka K, Ohyama K, et al. Relation between amount of bile ducts in portal canal and outcomes in biliary atresia[J]. Pediatr Surg Int, 2016, 32(9): 833-838. DOI:10.1007/s00383-016-3941-y. |
| 18 |
赵丽, 胡晓丽, 赵林胜, 等. 肝组织病理学评分在肝外胆道闭锁鉴别诊断中的意义[J]. 临床与实验病理学杂志, 2015(10): 1102-1106. DOI:10.13315/j.cnki.cjcep.2015.10.006. Zhao L, Hu XL, Zhao LS, et al. Values of histopathological assessment grading score in the differential diagnosis of extrahepatic biliary atresia[J]. J Clin Exp Pathol, 2015(10): 1102-1106. DOI:10.13315/j.cnki.cjcep.2015.10.006. |
| 19 |
Gouw AS, Clouston AD, Theise ND. Ductular reactions in human liver:diversity at the interface[J]. Hepatology, 2011, 54(5): 1853-1863. DOI:10.1002/hep.24613. |
| 20 |
Chen G, Xue P, Zheng S, et al. A pathological scoring system in the diagnosis and judgment of prognosis of biliary atresia[J]. J Pediatr Surg, 2015, 50(12): 2119-2123. DOI:10.1016/j.jpedsurg.2015.08.041. |
| 21 |
Kuo FY, Huang CC, Chen CL, et al. Immunohistochemical characterization of the regenerative compartment in biliary atresia:a comparison between Kasai procedure and transplant cases[J]. Hum Pathol, 2015, 46(11): 1633-1639. DOI:10.1016/j.humpath.2015.07.003. |
| 22 |
Chatzipantelis P, Lazaris AC, Kafiri G, et al. CD56 as a useful marker in the regenerative process of the histological progression of primary biliary cirrhosis[J]. Eur J Gastroenterol Hepatol, 2008, 20(9): 837-842. DOI:10.1097/MEG.0b013e3282fdf66f. |
| 23 |
Schmelzer E, Zhang L, Bruce A, et al. Human hepatic stem cells from fetal and postnatal donors[J]. J Exp Med, 2007, 204(8): 1973-1987. DOI:10.1084/jem.20061603. |
| 24 |
Schmelzer E, Wauthier E, Reid LM. The phenotypes of pluripotent human hepatic progenitors[J]. Stem Cells, 2006, 24(8): 1852-1858. DOI:10.1634/stemcells.2006-0036. |
| 25 |
慕永平, 张笑, 徐莹, 等. Notch信号通路参与大鼠胆汁性肝纤维化肝祖细胞向胆管上皮细胞分化以及肝纤维化进展[J]. 中华病理学杂志, 2017, 46(6): 400-405. DOI:10.3760/cma.j.issn.0529-5807.2017.06.007. Mu YP, Zhang X, Xu Y, et al. Notch signaling pathway participates in the differentiation of hepatic progenitor cells into bile duct epithelial cells and progression of hepatic fibrosis in cholestatic liver fibrosis rat[J]. Chin J Pathol, 2017, 46(6): 400-405. DOI:10.3760/cma.j.issn.0529-5807.2017.06.007. |
 2018, Vol. 17
2018, Vol. 17


