2. 天津市儿童医院(天津市, 300134);
3. 天津市第一中心医院(天津市, 300192);Email:13985153201@163.com
2. Department of Surgery, Tianjin Children's Hospital, Tianjin 300134, China;
3. First Central Municipal Hospital, Tianjin 300192, China.Email:13985153201@163.com
胆道闭锁(biliary atresia,BA)目前是婴幼儿时期危及患儿生命的肝胆系统疾病之一,以肝内外胆管梗阻、重度炎症和肝脏进行性纤维化为主要特征。胆道闭锁患儿肝纤维化进展迅速,多数患儿短期内即发生肝硬化,如未经治疗,很少有患儿活到2岁,是婴幼儿肝移植的主要手术指征[1, 2]。目前研究显示,TGF-β1促纤维化信号通路在胆道闭锁肝脏纤维化进程中发挥重要作用[3]。本研究旨在探讨BA患儿肝组织内TGF-β1促纤维化通路中Smad3、P-Smad3及产物蛋白人纤溶酶原激活物抑制因子1(plasminogen actirator inhibitor-1, PAI-1)在胆道闭锁不同纤维化分级肝组织中的表达情况,从而揭示PAI-1促进BA肝纤维化进程中的作用。
材料与方法 一、标本来源与分组收集天津市儿童医院2010年1月至2016年7月正常尸检(死于非肝胆系统疾病)5例肝脏组织为正常对照组,其中男童3例,女童2例;胆管扩张症患儿术中肝脏组织25例为胆扩组,其中男童10例,女童15例;BA患儿Kasai手术时肝活检组织25例为Kasai组,其中男童13例,女童12例。同时收集天津市第一中心医院2013年1月至2016年1月BA肝移植患儿自体肝组织25例为移植组,其中男童11例,女童14例,移植组皆于前期经过Kasai手术治疗。本实验通过天津市儿童医院及天津市第一中心医院伦理委员会审查。
二、研究方法1.标本处理:术中取各组患儿肝右叶前缘为肝活检标本,用10%福尔马林溶液固定8~24 h后经石蜡包埋储存,所有组别标本处理均于同一实验条件下进行。
2. HE染色:将已包埋肝脏蜡块切成4 mm厚切片经HE染色(经典染色法),由经验丰富的病理科医生在10×10、10×40光学显微镜下观察肝组织细胞发育、胆管细胞、炎症细胞浸润情况、汇管区情况、胆管增生情况、胆栓形成情况以及肝纤维化程度。常规试剂:如苏木素染液、伊红染液、0.01 M PBS(pH 7.2~7.4)、0.01 M枸橼酸盐缓冲液(pH 7.6)等。
3.免疫组化染色:(1)Smad3,为兔抗人单克隆抗体,规格:0.1 mL,目录编号:bs-3484R;P-Smad3,为兔抗人单克隆抗体,规格:0.1 mL,目录编号:bs-5617R;PAI-1,为兔抗人单克隆抗体,规格:0.5 mg,目录编号:bs-1704P;以上抗体皆于-20℃冰箱保存,购自北京博奥森生物技术有限公司。全部采用S-P两步法、兔抗人抗体:Smad3(1 : 200)、P-Smad3(1 : 200)、PAI-1(1 : 200),在低倍镜(10×)下观察切片染色(棕色)区域,高倍镜(40×)下辨别不同阳性细胞及其表达情况。(2)免疫组化阳性标准[4]:①定性分析:根据染色强度分为,无棕黄色(-);淡棕黄色(+);棕黄色(++);棕褐色(+++)。根据阳性细胞数判断大体阳性细胞率,无阳性细胞数为(-);阳性细胞≤10%为(+);阳性细胞数在11% ~50%为(++);阳性细胞数>50%为(+++)。本研究中规定(-)为0分,每一个(+)为1分,根据着色结果将组织阳性程度评分。0分为阴性,1~2分为弱阳性,3~4为阳性,5~6为强阳性。②半定量分析:肝组织阳性细胞位置/阳性面积为平均光密度值。于每张切片阳性部位随机选取5个视野,用同一计算机成像系统留取10×10显微镜下图片,IPP(Image pro-plus)6.0分析图片计算PAI-1等蛋白平均光密度值。
三、统计学处理本研究采用Microsoft Excel 2007 (Microsoft Corp, Redmond, Wash)和SPSS15.0(SPSS Inc, Chicago, Ⅲ)进行数据收集和统计分析。对于计量资料先进行正态性检验,如服从正态分布采用(x±s)表示, 多组间比较采用ANOVA方差分析,如果方差分析有意义则进一步采用SNK法进行两两比较;两组间比较采用独立样本t检验。以α=0.05为检验水准,P < 0.05为差异有统计学意义。
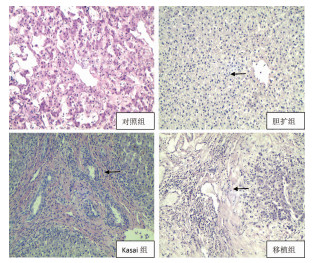
结 果 一、四组肝纤维化情况HE染色结果提示:对照组肝脏HE染色显示无纤维化;胆扩组肝脏HE染色显示少许炎性细胞浸润,少许纤维细胞增生,无明显胆管增生及纤维化;Kasai组肝脏HE染色显示大量纤维细胞、炎性细胞浸润,胆管增生及肝纤维化较重;移植组肝脏HE染色显示大量纤维组织增生,假小叶形成,肝硬化(图 1)。
|
Download:
|
| 图 1 四组患儿肝脏纤维化情况(HE,10×10) 注黑色箭头所指展示纤维组织在各组增生情况 Fig. 1 Degree of liver fibrosis in four groups (HE, 10×10) Black arrows indicated the proliferation of fibrous tissue in each group | |
1.半定量分析结果显示,Kasai组Smad3、P-Smad3及PAI-1表达量明显高于其他三组(P < 0.001)。三种蛋白在Kasai组的含量与其他三组相比差异有统计学意义(P < 0.001),具体见表 1。
|
|
表 1 四组肝内Smad3、P-Smad3及PAI-1半定量表达(x±s) Table 1 Semiquantitative expressions of Smad3, P-Smad3 and PAI-1 in four groups(x±s) |
2.对比Kasai组3种蛋白的均值关系发现:Smad3含量高于P-Smad3含量,而P-Smad3与PAI-1含量相当,具体见表 1。
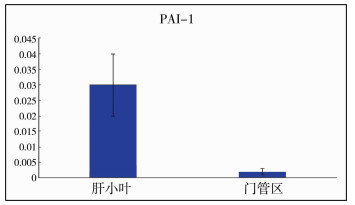
3. Kasai组PAI-1含量:肝小叶内(0.03±0.01)PAI-1含量高于门管区(0.002±0.001),差异具有统计学意义(t=13.76,P < 0.001),具体见图 2。
|
Download:
|
| 图 2 Kasai组PAI-1在肝小叶与门管区的表达量对比 Fig. 2 Comparison of expression of PAI-1 in hepatic lobules and portal area in Kasai group | |
镜下见PAI-1在尸检组肝细胞质呈阴性表达;胆扩组肝细胞质呈弱阳性表达;Kasai组肝细胞质呈强阳性表达;在移植组肝细胞质呈强阳性表达(图 3)。

|
Download:
|
| 图 3 PAI-1在四组患儿定性表达示例(免疫组化,10×10) 注箭头所指展示PAI-1蛋白在各组细胞质表达;尸检组:PAI-1在胞质、胞核皆阴性表达;胆扩组:PAI-1在胞质弱阳性,胞核阴性;Kasai组:PAI-1在胞质强阳性,胞核阴性;移植组:PAI-1在胞质阳性,胞核阴性。 Fig. 3 Expression of PAI-1 in four groups The arrows indicated the expression of PAI-1 protein in cytoplasm of each group.Autopsy group:PAI-1 was negatively expressed in cytoplasm and nucleus; CBD group:PAI-1 was weakly positive in cytoplasm and negative in nucleus; Kasai group:PAI-1 was strongly positive in cytoplasm and negative in nuclei; Transplantation group:PAI-1 was positive in cytoplasm and negative in nuclei. | |
在胆道闭锁肝纤维化进程中,TGF-β1蛋白与其受体结合后诱导肝细胞胞质内Smad2/3磷酸化生成P-Smad2/3,P-Smad2/3结合Smad4形成一个络合物向细胞核移动启动细胞外基质蛋白的基因转录,增加PAI-1等一系列蛋白表达而促进肝纤维化进程[4, 5]。PAI-1在BA肝纤维化中具有促纤维化作用,本文基于前期研究基础,设立实验进一步探讨PAI-1在BA肝纤维化进程中的作用机制。
一、PAI-1促BA肝纤维化作用PAI-1由379个氨基酸残基组成,是丝氨酸蛋白酶抑制剂家族的一员。PAI-1在体内有3种存在形态,即活性态、潜伏态和底物态,只有活性态的PAI-1可与组织型纤溶酶原激活物结合。体内PAI-1大多以潜伏态存在,应用变性剂如十二烷基硫酸钠、尿素、盐酸胍等可使潜伏态的PAI-1重新激活为活性态的PAI-1。PAI-1是体内重要的纤溶活性调节者。PAI-1的定性分析可见,其于尸检组呈阴性表达,Kasai组呈强阳性表达,且有随着尸检、胆扩组至Kasai组肝纤维化程度的加重,PAI-1含量逐渐增高。在促胆道闭锁肝纤维化路径中,TGF-β1通过整合素蛋白αvβ6等因素的启动,促进PAI-1生成,其作用机制主要通过抑制抗纤维化蛋白酶抑制剂促进肝脏组织纤维化[6]。本实验中Kasai组PAI-1表达量明显高于其他三组,这与PAI-1在肝纤维化进程中促纤维化作用理论相吻合,说明TGF-β1促纤维化通路在BA中的促纤维化作用。丁美云[7]研究提出在BA肝纤维化进程中PAI-1的产生与P-Smad3的含量相关,其分泌可能受通路中P-Smad3含量的影响。本实验中,P-Smad3与PAI-1含量在不同纤维化进程中表达相当,实验数据支持PAI-1的生成与P-Smad3的密切关系,进一步证明Smad3磷酸化为P-Smad3的过程是BA肝纤维化进程的关键步骤。
二、PAI-1在BA肝小叶显著促纤维化BA肝纤维化以肝内外胆管梗阻、大量畸形胆管增生为主要特征,激活贮脂细胞,刺激胶原蛋白等促纤维化物质生成,肝小叶内肝细胞变性、坏死、凋亡,细胞外基质增多,纤维化病变显著。TGF-β1促纤维化通路的促纤维化作用虽已有众多研究,然而其促纤维化机制及肝内主要作用部位尚未见报道[8, 9]。目前,国内外文献倾向于胆小管增生是BA肝脏纤维化的诱因,然而BA肝脏纤维化是由大量肝细胞坏死、炎性细胞浸润、胶原蛋白生成等,细胞外基质增殖,逐渐吞噬原有肝细胞、肝板等正常结构而形成纤维病变组织[10]。BA肝内门管区胆小管与肝小叶内肝细胞等组织如何促进肝纤维化过程仍是亟需解决的问题。本实验将Kasai组患儿肝组织分为门管区与肝小叶两组,计算PAI-1在两组中的不同表达,发现PAI-1于肝小叶的表达强于门管区,PAI-1在肝小叶含量更高,这意味着PAI-1在肝小叶比门管区有更强的促纤维化作用。PAI-1为TGF-β1促纤维化通路产物,反映促纤维化通路的作用方向,这提示TGF-β1通路的促纤维化作用更可能通过损害BA肝小叶结构组织而具体表现出来。
三、PAI-1促进BA早期肝纤维化经HE染色可见尸检组肝组织无纤维化表现,胆扩组肝内少许纤维细胞增生,Kasai组肝组织大量纤维组织增生,肝纤维化程度较重,移植组假小叶形成,肝内大量纤维瘢痕分割肝组织,形成肝硬化。本实验BA患儿肝内PAI-1、Smad3、P-Smad3含量增高,在BA肝纤维化过程,PAI-1、Smad3、P-Smad3高表达,生成大量细胞外基质导致细胞外基质细胞增殖失衡,肝纤维化逐渐加重。BA患儿晚期肝硬化时肝脏病理表现见大量假小叶和间质纤维组织,PAI-1、Smad3、P-Smad3等蛋白大量减少。研究认为BA肝硬化时期肝脏结构功能紊乱,大量增生的胆管逐渐闭塞、各类细胞数目逐渐减少,肝内组织被胶原纤维广泛代替[11-13]。由于肝硬化时BA患儿肝脏对机体所受各种损伤已失去相适应的反应能力,促纤维化机制不能有序进行,细胞数目大量减少,肝内组织细胞失去原有适应功能,难以对病变做出反应,导致TGF-β1等各种蛋白来源减少,PAI-1的表达也随之减少[14-15]。同时原有蛋白可能成为肝内异物被炎症细胞、成纤维细胞等吞噬、纤维化,逐渐被胶原纤维组织所替代,从而进一步加重胆道闭锁的肝硬化程度。
四、展望肝脏纤维化是阻碍BA治疗的重要病因,如何阻止胆道闭锁肝纤维化进程是挽救BA患儿肝脏功能的重要工作。因此,研究BA肝纤维化的发生机制具有重要的临床意义。通过本实验研究证实PAI-1促进BA肝小叶的早期纤维化作用显著,这为如何通过TGF-β1促纤维化通路阻碍BA肝纤维化进程提供了更详细的方向。将来的实验中应探讨阻断BA患儿肝内TGF-β1促纤维化通路是否能减缓肝小叶的纤维化过程,保护肝脏正常结构,从而将阻断肝纤维化的基础研究转向临床抗纤维化的精准治疗,为广大BA患儿带来福音。
| 1 |
管志伟, 詹江华, 罗喜荣, 等. 天津及周边地区胆道闭锁的流行病学调查[J]. 临床小儿外科杂志, 2012, 11(5): 329-331. DOI:10.3969/j.issn.1671-6353.2012.05.003. Guan ZW, Zhan JH, Luo XR, et al. Epidemiological investigation in biliary atresia of Tianjin and surrounding areas[J]. J Clin Ped Sur, 2012, 11(5): 329-331. DOI:10.3969/j.issn.1671-6353.2012.05.003. |
| 2 |
Gaarenstroom T, Hill CS. TGF-β signaling to chromatin:how Smads regulate transcription during self-renewal and differentiation[J]. Semin Cell Dev Biol, 2014, 32(1): 107-118. DOI:10.1016/j.semcdb.2014.01.009. |
| 3 |
Massagué J. TGFβ signalling in context[J]. Nat Rev Mol Cell Biol, 2012, 13(10): 616-630. DOI:10.1038/nrm3434. |
| 4 |
Kisseleva T. Myofibroblasts revert to an inactive phenotype during re-gression of liver fibrosis[J]. Proc Natl Acad Sci USA, 2012, 109(24): 9448-9453. DOI:10.1073/pnas.1201840109. |
| 5 |
Zhang Xb, Min KW, Liggett Jason, et al. Disruption of the transforming growth factor-beta pathway by tolfenamic acid via the ERK MAP kinase pathway[J]. Carcinogenesis, 2013, 34(12): 2900-2907. DOI:10.1093/carcin/bgt250. |
| 6 |
Markovics JA, Araya J, Cambier S, et al. Interleukin-1beta induces increased transcriptional activation of the transforming growth factor-beta-activating integrin subunit beta8 through altering chromatin architecture[J]. J Biol Chem, 2011, 286(42): 36864-36874. DOI:10.1074/jbc.M111.276790. |
| 7 |
丁美云, 詹江华, 赵丽, 等. P-Smad3在胆道闭锁肝纤维化中的作用机制研究[J]. 临床小儿外科杂志, 2016, 15(1): 29-33. DOI:10.3969/j.issn.1671-6353.2012.05.003. Ding MY, Zhan JH, Zhao L, et al. The study on mechanism of P-Smad3 in hepatic fibrosis of biliary atresia[J]. J Clin Ped Sur, 2016, 15(1): 29-33. DOI:10.3969/j.issn.1671-6353.2012.05.003. |
| 8 |
Salzedas-Netto AA, Chinen E, de Oliveira DF, et al. Grade Ⅳ fibrosis interferes in biliary drainage after Kasai procedure[J]. Transplant Proc, 2014, 46(6): 1781-1783. DOI:10.1016/j.transproceed.2014.05.045. |
| 9 |
Iordanskaia T, Hubal MJ, Koeck E, et al. Dysregulation of upstream and downstream transforming growth factor-β transcripts in livers of children with biliary atresia and fibrogenic gene signatures[J]. J Pediatr Surg, 2013, 48(10): 2047-2053. DOI:10.1016/j.jpedsurg.2013.03.047. |
| 10 |
周李, 金龙, 刘钧澄, 等. 胆小管增生诱导胆道闭锁早期肝纤维化[J]. 中华小儿外科杂志, 2005, 26(6): 281-284. DOI:10.3760/cma.j.issn.0253-3006.2005.06.001. Zhou L, Jin L, Liu JC, et al. Bile duct proliferation induces early biliary atresia in liver fibrosi[J]. Chin J Pediatr Surg, 2005, 26(6): 281-284. DOI:10.3760/cma.j.issn.0253-3006.2005.06.001. |
| 11 |
宋亭亭, 詹江华, 高伟, 等. 胆道闭锁肝组织CD14、CD34、TGF-β1表达研究[J]. 中华小儿外科杂志, 2015, 36(1): 24-28. DOI:10.3760/cma.j.issn.0253-3006.2015.01.015. Song TT, Zhan JH, Gao W, et al. Expression of CD14, CD34 and transforming growth factor-β1 in liver biopsy of biliary atresia[J]. Chin J Pediatr Surg, 2015, 36(1): 24-28. DOI:10.3760/cma.j.issn.0253-3006.2015.01.015. |
| 12 |
詹江华, 宋亭亭, 高伟, 等. 胆道闭锁自体肝病理学研究3例[J]. 临床小儿外科杂志, 2015, 14(4): 335-337. DOI:10.3969/j.issn.1671-6353.2015.04.025. Zhan JH, Song TT, Gao W, et al. Autologous liver pathology of biliary atresia:a report of 3 cases[J]. J Clin Ped Sur, 2015, 14(4): 335-337. DOI:10.3969/j.issn.1671-6353.2015.04.025. |
| 13 |
刘丹丹, 詹江华, 高伟, 等. 胆道闭锁患儿肝门的病理解剖学研究[J]. 临床小儿外科杂志, 2015, 14(1): 20-24. DOI:10.3969/j.issn.1671-6353.2015.01.006. Liu DD, Zhan JH, Gao W, et al. Pathological anatomy of hepatic door in patients with biliary atresi (BA)[J]. J ClinPed Sur, 2015, 14(1): 20-24. DOI:10.3969/j.issn.1671-6353.2015.01.006. |
| 14 |
Lee JH, Lee H, Joung YK, et al. The use of low molecular weight heparin-pluronic nanogels to impede liver fibrosis by inhibition the TGF-β/Smad signaling pathway[J]. Biomaterials, 2011, 32(5): 1438-1445. DOI:10.1016/j.biomaterials.2010.10.023. |
| 15 |
Kamato D, Burch ML, Piva TJ, et al. Transforming growth factor-β signaling:role and consequences of Smad linker region phosphorylation[J]. Cell Signal, 2013, 25(10): 2017-2024. DOI:10.1016/j.cellsig.2013.06.001. |
 2018, Vol. 17
2018, Vol. 17
