头臼“同心圆复位”是发育性髋关节发育不良(developmental dysplasia of the hip, DDH)闭合复位治疗的目标。头臼同心是髋关节能获得正常发育的前提条件,尽早恢复髋关节头臼同心的解剖关系,是获得功能正常髋关节的唯一途径。但在临床上并非所有DDH在闭合复位后均能立即达到同心圆复位,一定程度的非同心圆复位是否可接受,仍存在争议。有学者认为复位后即应达到完全同心[1, 2];而另一观点认为一定程度的关节间隙增宽是可以接受的,经过复位后短期制动,股骨头可逐渐“靠港”(docking)而达到同心圆复位[3]。但DDH非同心圆复位后头臼关系的演变尚缺乏直观的证据。
DDH闭合复位后准确评估头臼的位置关系至关重要。既往研究多是借助于关节造影下间接观察,不能直接反应软骨性头臼间的位置关系,而磁共振(magnetic resonance imaging, MRI)不仅具有无创、无痛、无离子辐射等优点,更重要的是能从多平面清晰、直观地显示髋关节所有骨性及非骨性组织结构[4, 5]。目前,MRI已越来越多地应用于闭合复位后对同心圆复位程度的评价,但通过MRI对复位后同心圆复位情况随时间演变的观察,尚未见相关报道。本研究采用前瞻性研究的方法,通过系列MRI影像学观察DDH患儿稳定闭合复位后头臼位置关系的演变规律。
材料与方法 一、临床资料前瞻性收集2014年3月至2015年6月在中国医科大学附属盛京医院小儿骨科住院行闭合复位治疗的DDH患儿(术后Spica石膏固定3个月后,更换髋外展支具继续固定3个月)作为研究对象。纳入标准为:①全麻下行闭合复位(或同时经皮长收肌腱切断)治疗的;②获得安全稳定的复位,即复位后检查安全角范围>30°,且维持复位的髋外展角度<65°[6];③具有完整的影像学资料,包括术前及最后随访时的骨盆正位片,复位后(术后3 d内)、术后3或6个月、1年和2年的MRI影像资料;④术后随访时间至少2年。排除标准为:①既往经过任何方式治疗者;②神经源性、综合症性及其它原因的DDH患儿;③影像学资料不完整的患儿。
最终符合纳入和排除标准的DDH患儿共30例(35髋),其中男童6例,女童24例;左髋脱位17例,右髋脱位8例,双侧脱位5例。复位时平均年龄13.7个月(3.5~27.6个月)。最后随访时间为2017年10月,平均随访36.3个月(28.5~43.9个月)。
二、影像学测量与评定所有影像学参数测量及评定均在中国医科大学附属盛京医院PACS系统中完成。具体参数及测量方法如下:
1. IHDI分型(International Hip Dysplasia Institute, IHDI):在复位前骨盆正位片上按IHDI方法进行脱位程度的分型[7]。
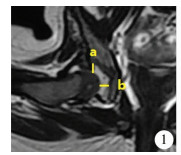
2.上方关节间隙(superior joint space, SJS):在复位后及随访时的髋关节MRI影像上,通过三角软骨中心的冠状位T1或T2加权图像上,测量髋关节的上方间隙,即软骨性股骨头的最上缘与软骨性髋臼缘的垂直距离(图 1)。
|
Download:
|
| 图 1 MRI冠状位图像上关节间隙的测量 注 通过三角软骨中心的冠状位影像测量上方间隙(a)与内侧间隙(b) Fig. 1 Measurement of joint space on coronal image of MRI | |
3.内侧关节间隙(medial joint space, MJS):在复位后及随访时的髋关节MRI影像上,通过三角软骨中心的冠状位T1或T2加权图像,测量软骨性股骨头的最内侧缘与软骨性髋臼缘的水平距离为内侧关节间隙(图 1)。同时根据冠状位图像关节间隙的测量结果对同心圆复位情况进行评价,如果关节间隙等宽且≤2 mm,则定义为同心圆复位;如果关节间隙不等宽或等宽但>2 mm则为非同心圆复位。
4.髋臼指数(acetabular index, AI):在骨盆正位片上,双侧三角软骨顶点的连线为H线(Hilgenreiner's线),三角软骨外上缘与髋臼外上缘的连线与H线的夹角即为AI。
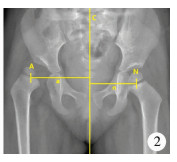
5.股骨头中心距离差(centre-head distance discrepancy, CHDD):根据Chen等[8]提出的方法进行测量。在单侧DDH的骨盆正位片上,经骶骨中心与耻骨联合中心做身体的中线,A点与N点分别为脱位侧及正常侧股骨头的中心,两股骨头中心至身体中线的垂直距离分别为a与n,CHDD=[(a-n)/n]×100%(图 2)。
|
Download:
|
| 图 2 骨盆正位片上CHDD的测量 注 A点与N点分别为DDH患儿脱位侧及正常侧股骨头的中心,C线为身体的中线,a与n分别代表A点、N点至C线的垂直距离 Fig. 2 Measurement of CHDD on anterior-posterior pelvic radiograph | |
6.股骨头缺血性坏死(avascular necrosis, AVN):根据Salter标准[9]评定是否发生AVN,具体指征包括:①复位1年后股骨头的骨骺仍未出现;②复位1年后现有的骨骺生长发育停滞;③复位1年后,股骨颈变宽;④影像学上出现股骨头密度增加或碎裂现象;⑤股骨头骨化完成后有扁平髋、髋内翻、股骨颈短宽等残余畸形。如确定出现AVN,则进一步依据Kalamchi-MacEwen标准[10]进行分型。
三、统计学处理采用SPSS19.0软件进行统计学分析。采用配对样本t检验比较复位前后上方及内侧关节间隙、复位后CHDD,以及术前与末次随访时AI的差异;采用独立样本t检验比较AVN与复位时年龄的关系;采用Fisher确切概率法比较AVN与复位前IHDI分型的分布差异。以P & 0.05为差异有统计学意义。
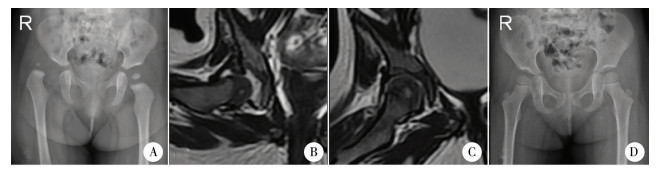
结 果35髋中,复位前按IHDI分型:Ⅰ型2髋、Ⅱ型11髋、Ⅲ型13髋、Ⅳ型9髋。复位后6个月时上方关节间隙、内侧关节间隙与复位术后比较,均明显变小,差异有统计学意义(P < 0.001),见表 1。同心圆复位的演变情况:复位后当时仅3髋(8.6%)达到同心圆复位;术后当时未达到同心圆复位的32髋经石膏及支具制动,复位6个月后,有21髋(21/32,65.6%)自行达到同心圆复位,另11髋复位后12个月时有6髋(6/11,54.5%)达到同心圆复位(图 3)。
|
|
表 1 30例(35髋)DDH患儿闭合复位后上方及内侧关节间隙的变化(x±s) Table 1 Changes of superior and medial joint space after closed reduction in 30 DDH children (35 hips)(x±s) |
复位前AI平均为(34.4±5.3)°(26~48°),末次随访时AI平均为(23.5±3.7)°(14° ~31°),差异有统计学意义(t=16.986,P < 0.001)。单侧DDH(25髋)复位后CHDD的变化情况,复位后6个月时平均为(3.28±4.31)%(-9.87% ~9.66%),末次随访时平均为(3.13±3.09)%(-1.50% ~12.12%),差异无统计学意义(t=0.166,P=0.869)。末次随访时有3髋CHDD>6%。
根据Salter的AVN评定标准,在最后随访时,35髋中有8髋发生AVN,占22.9%,且均为Ⅰ型坏死。发生AVN组复位时年龄为(17.7±6.8)个月,未发生AVN组复位时年龄为(12.5±6.1)个月,差异有统计学意义(t=2.063,P=0.047);术前IHDI分型与AVN的分布如表 2。Ⅰ、Ⅱ、Ⅲ型DDH股骨干骺端中点均位于Hilgenreiner's线以下,因此合并Ⅰ、Ⅱ、Ⅲ型为低脱位组(2髋AVN),Ⅳ型为高脱位组(6髋AVN), 则不同脱位高度AVN的发生率有统计学差异(P=0.001)。进一步采用Fisher确切概率法对任两种分型比较,按α=0.008水准,Ⅱ型与Ⅳ型AVN的发生率有统计学差异(P=0.002);Ⅲ型与Ⅳ型AVN的发生率有统计学差异(P=0.007);其余任意两种分型AVN的发生率均无统计学差异(P>0.008)。
|
Download:
|
| 图 3 闭合复位后髋关节同心的演变情况 注 患儿女,右侧髋脱位,复位时年龄为8.3个月,A:术前骨盆正位片,IHDI分型为Ⅲ型;B:闭合复位术后当时MRI图像,上方间隙为5.35 mm,内侧间隙为4.83 mm,未达到同心圆复位;C:复位术后6个月时MRI图像,关节间隙小于2 mm达到同心圆复位;D:复位术后2.5年骨盆正位片,发育良好 Fig. 3 Docking of femoral head in a girl with right DDH after closed reduction | |
|
|
表 2 30例(35髋)DDH患儿术前IHDI分型与AVN的分布情况 Table 2 Distribution of IHDI classification and avascular necrosis after closed reduction in 30 DDH children (35 hips) |
“头臼同心”是髋关节正常发育的前提,是DDH闭合或切开复位治疗的最终目标。目前,6~18月龄DDH治疗的首选方案仍然是闭合复位[11]。但由于圆韧带及髋臼内纤维脂肪组织的间置,闭合复位后很难获得真正的同心圆复位。另外,DDH的髋臼缘多存在发育不良、髋臼的坐骨部分增厚而向臼内突起,导致髋臼并非理想的球面,同时DDH的股骨头也并非完全的球形,因此即使切开复位也不能达到完全的头臼同心[12]。临床上所谓的“同心圆复位”,更大程度是指头臼的最大接触复位,既往研究多根据复位后关节内侧造影池的宽度来衡量股骨头复位的程度。Lönnerholm[13]把内侧造影池宽度≤2 mm定义为“同心圆复位”,但目前尚没有被广泛接受的MRI定量标准。有研究表明,通过关节造影测量的造影池宽度与MRI测量的关节间隙无明显差别[14]。因此本研究借用关节造影的标准,在MRI影像上,如果复位后关节间隙等宽且≤2 mm,则定义为同心圆复位;如果关节间隙不等宽或等宽但>2 mm均视为非同心圆复位。
目前,国际上对DDH闭合复位是否可以接受主要考虑两方面因素,一是复位后的维持,二是复位质量。维持复位的基本条件是“稳定”与“安全”,所谓稳定,即复位后从最大外展至内收再脱位的安全区应>30°[6];所谓安全,是髋外展位固定时相对于AVN风险而言的,如果需髋外展>65°固定来维持复位,将明显增加AVN的风险,因此是不被接受的,如需内旋髋关节来增加稳定,也不应内旋超过15°[6]。“安全”、“稳定”作为DDH闭合复位的前提,目前国际上的认识是一致的,但对可接受的复位质量仍存在争议。有学者认为,“同心圆复位”是髋关节正常发育的前提,因此如果只接受术后完全的同心圆复位,那么任何关节间隙的增宽均需行切开复位,显然这会明显增加切开复位率[15, 16]。而大多数学者则认为闭合复位后一定程度的关节间隙增宽是可以接受的,随着一段时间的制动,嵌入关节内的软组织可逐渐吸收塑形,股骨头可达到完全复位。Severin[3]在1950年首先报告了这一现象,并称之为“靠港”。后续有研究均支持“靠港”理论的存在,但目前对闭合复位后关节间隙增宽的程度认识仍存在争议[17-19]。1983年,Race与Herring的报道认为,在稳定复位的前提下内侧造影池≤7 mm是可接受的,而更多的研究则接受≤3~4 mm的标准[13, 20, 21]。争议原因可能是不同研究在测量关节间隙时因设备的放大率不同所致,因此,Gans等[14]用内侧造影池宽度与股骨头直径的比值来衡量复位质量,认为该比值≤16%与良好的预后有关。
本研究中,仅把安全、稳定作为选择闭合复位的标准,并未考虑复位后关节间隙增宽的程度。在复位后当时仅3髋(8.6%)达到同心圆复位,其余32髋经石膏及支具固定,复位6个月后,21髋(65.6%)自行达到同心圆复位,复位1年后27髋(84.4%)达到同心圆复位,可见闭合复位时达到“安全、稳定”的前提下,复位后关节制动的6个月,是嵌插软组织吸收塑形、股骨头趋向“同心圆”的关键时期;而在去除制动后的6个月(复位后1年),仍有54.5%(6/11)的非同心圆复位髋可自行达到同心圆复位。就内侧关节间隙宽度而言,通过闭合复位后的MRI测量,平均为3.16 mm (最大5.70 mm),与既往研究结果类似[13, 20, 21]。而在6个月的制动后,内侧间隙平均为1.28 mm,这有赖于髋臼底纤维脂肪的吸收及圆韧带的塑形,因此本研究也证实“靠港”理论的存在。既往研究仅关注了内侧关节间隙,本研究也同时观察了闭合复位后上方关节间隙的演变,上方关节间隙的增宽则主要来自于增生肥大,或内翻的盂唇,复位后增大的上方间隙随关节制动也可逐渐减小,这依赖于盂唇的形态演变。Severin[3]认为内翻的盂唇可随复位时间的延长而逐渐被吸收,但本研究并不支持这一理论,在最后随访时,仍有部分内翻的盂唇未完全消失,而是压缩为一薄层纤维垫嵌于关节上方间隙,通过X线片不能观察到,其远期转归如何尚需进一步随访。
本研究所提出的“稳定”复位,即指闭合复位当时对复位维持的评估,也指去除外固定后髋关节长期保持“同心圆”的稳定。如闭合复位后关节内侧间隙持续增宽或半脱位,必将导致不良后果,但目前对去除外固定后关节间隙增宽可接受程度的研究较少。1994年,Chen等[8]首先报道了CHDD与单侧DDH远期结果的相关性,他们认为在闭合复位后1年时CHDD≤6%,有96%的髋可获得满意结果(Severin Ⅰ或Ⅱ型髋),而在CHDD>6%的髋中,则有78%结果不满意,在随后的研究中也支持CHDD与预后的相关性[22-24]。本研究中单侧DDH共25例(25髋),术后1年内CHDD平均为3.28%,至最后随访时为3.13%,差异无统计学意义,这表明达到同心圆复位的髋关节可获得稳定的维持,可预测良好的远期结果。同时,复位后AI的变化也与预后相关[25, 26]。本组闭合复位的患儿经平均36.3个月随访,发现髋臼形态在逐渐改善。但本组病例仅为短期随访,不能代表骨成熟时的远期结果,这也是本研究的局限之一。DDH同心圆复位后能稳定地维持,是髋关节正常发育的前提,但并不是所有髋关节均可发育至正常。Sankar等[27]通过前瞻性、多中心队列研究发现,在成功闭合复位的DDH中仍有11%的患儿将来需行骨盆或同时股骨近端截骨矫正残余髋臼发育不良,因此本组病例仍需长期随访。
AVN是DDH治疗常见的、最严重的并发症。根据Salter评定标准,本研究中35髋有8髋发生AVN,发生率为22.9%,且均为Ⅰ型AVN, 与近期的研究结果相似[27]。多数学者认为Ⅰ型AVN并不是真正的坏死,而是暂时的骨骺发育紊乱,可恢复正常发育,因此并不影响远期结果。本研究结果表明复位时年龄大、脱位程度高与AVN的发生相关,这与既往研究结果一致[28, 29]。目前,对AVN的诊断均是基于放射线的形态学分析,而AVN的形态学表现是一个长期发育的过程,一些类型的AVN至青春期前后才表现明显(如Ⅱ型)。本组病例最长随访为43.9个月,因此尚不能对真正的AVN发生率做准确评估。
总之,尽管本研究有上述诸多局限性,但是其为前瞻性设计,一定程度上减少了信息偏倚;此外,本研究首次通过系列MRI观察了闭合复位后头臼位置关系的演变,相对于以往的放射线学观察,可更直观、准确地评估股骨头复位及软组织病理结构。研究结果表明,对于达到稳定、安全闭合复位的DDH患儿,非同心圆复位可随股骨头的逐渐“靠港”而达到同心圆复位,并可稳定维持同心圆复位,促进髋臼病理形态的改善,但远期结果仍需长期随访。
| 1 |
Biçimogğlu A, Ağuş H, Omeroğlu H, et al. Posteromedial limited surgery in developmental dysplasia of the hip[J]. Clin Orthop Relat Res, 2008, 466(4): 847-855. DOI:10.1007/s11999-008-0127-5. |
| 2 |
Somerville EW, Scott JC. The direct approach to congenital dislocation of the hip[J]. J Bone Joint Surg Br, 1957, 39- B(4): 2504-2510. |
| 3 |
Severin E. Congenital dislocation of the hip; development of the joint after closed reduction[J]. J Bone Joint Surg Am, 1950, 32- A(3): 507-518. |
| 4 |
Zhang ZL, Fu Z, Yang JP, et al. Intraoperative arthrogram predicts residual dysplasia after successful closed reduction of DDH[J]. Orthop Surg, 2016, 8(3): 338-344. DOI:10.1111/os.12273. |
| 5 |
Galek-Aldridge MS, de Graeff JJ, Struijs PAA. Closed reduction of congenital dislocation of the hip:prediction factors and results[J]. J Pediatr Orthop B, 2018, 27(5): 391-393. DOI:10.1097/BPB.0000000000000504. |
| 6 |
Ramsey PL, Lasser S, Macewen GD. Congenital dislocation of the hip:use of the Pavlik harness in the child during the first six months of life[J]. J Bone Joint Surg Am, 1976, 58(7): 1000-1004. DOI:10.2106/00004623-197658070-00017. |
| 7 |
Narayanan U, Mulpuri K, Sankar WN, et al. Reliability of a new radiographic classification for developmental dysplasia of the hip[J]. J Pediatr Orthop, 2015, 35(5): 478-484. DOI:10.1097/BPO.0000000000000318. |
| 8 |
Chen IH, Kuo KN, Lubicky JP. Prognosticating factors in acetabular development following reduction of developmental dysplasia of the hip[J]. J Pediatr Orthop, 1994, 14(1): 3-8. DOI:10.1097/01241398-199401000-00002. |
| 9 |
Salter RB, Kostuik J, Dallas S. Avascular necrosis of the femoral head as a complication of treatment for congenital dislocation of the hip in young children:a clinical and experimental investigation[J]. Can J Surg, 1969, 12(1): 44-61. |
| 10 |
Kalamchi A, MacEwen GD. Avascular necrosis following treatment of congenital dislocation of the hip[J]. J Bone Joint Surg Am, 1980, 62(6): 876-888. DOI:10.2106/00004623-198062060-00002. |
| 11 |
Kotlarsky P, Haber R, Bialik V, et al. Developmental dysplasia of the hip:What has changed in the last 20 years?[J]. World J Orthop, 2015, 6(11): 886-901. DOI:10.5312/wjo.v6.i11.886. |
| 12 |
Sankar WN, Neubuerger CO, Moseley CF. Femoral head sphericity in untreated developmental dislocation of the hip[J]. J Pediatr Orthop, 2010, 30(6): 558-561. DOI:10.1097/BPO.0b013e3181e4f53e. |
| 13 |
Lönnerholm T. Arthrography of the hip in children:technique, normal anatomy and findings in unstable hip joints[J]. Acta Radiol Diagn (Stockh), 1980, 21(2): 279-371. DOI:10.1177/028418518002102B05. |
| 14 |
Gans I, Sankar WN. The medial dye pool revisited:correlation between arthrography and MRI in closed reductions for DDH[J]. J Pediatr Orthop, 2014, 34(8): 787-790. DOI:10.1097/BPO.0000000000000187. |
| 15 |
Kim HT, Lee TH, Ahn TY, et al. The fate of DDH hips showing cartilaginous or fibrous tissue-filled joint spaces following primary reduction[J]. J Pediatr Orthop, 2017, 37(3): 184-191. DOI:10.1097/BPO.0000000000000621. |
| 16 |
Tarassoli P, Gargan MF, Atherton WG, et al. The medial approach for the treatment of children with developmental dysplasia of the hip[J]. Bone Joint J, 2014, 96- B(3): 406-413. DOI:10.1302/0301-620X.96B3.32616. |
| 17 |
Watanabe W, Itoi E, Yamada S, et al. Decreased interposition after closed reduction in the hip joint:a case of developmental dislocation of the hip observed by MRI[J]. J Orthop Sci, 2002, 7(3): 397-399. DOI:10.1007/s007760200066. |
| 18 |
Chin MS, Betz BW, Halanski MA. Comparison of hip reduction using magnetic resonance imaging or computed tomography in hip dysplasia[J]. J Pediatr Orthop, 2011, 5(31): 525-529. DOI:10.1097/BPO.0b013e31821f905b. |
| 19 |
Duffy CM, Taylor FN, Coleman L, et al. Magnetic resonance imaging evaluation of surgical management in developmental dysplasia of the hip in childhood[J]. J Pediatr Orthop, 2002, 22(1): 92-100. |
| 20 |
Drummond DS, O'Donnell J, Breed A, et al. Arthrography in the evaluation of congenital dislocation of the hip[J]. Clin Orthop Relat Res, 1989, 243(243): 148-156. |
| 21 |
Tennant SJ, Eastwood DM, Calder P, et al. A protocol for the use of closed reduction in children with developmental dysplasia of the hip incorporating open psoas and adductor releases and a short-leg cast:mid-term outcomes in 113 hips[J]. Bone Joint J, 2016, 98- B(11): 1548-1553. DOI:10.1302/0301-620X.98B11.36606. |
| 22 |
Kim HT, Kim JI, Yoo CI. Acetabular development after closed reduction of developmental dislocation of the hip[J]. J Pediatr Orthop, 2000, 20(6): 701-708. DOI:10.1097/01241398-200011000-00002. |
| 23 |
Kitoh H, Kitakoji T, Katoh M, et al. Prediction of acetabular development after closed reduction by overhead traction in developmental dysplasia of the hip[J]. J Orthop Sci, 2006, 11(5): 473-477. DOI:10.1007/s00776-006-1049-2. |
| 24 |
Tsukagoshi Y, Kamegaya M, Kamada H, et al. The correlation between Salter's criteria for avascular necrosis of the femoral head and Kalamchi's prognostic classification following the treatment of developmental dysplasia of the hip[J]. Bone Joint J, 2017, 99- B(8): 1115-1120. DOI:10.1302/0301-620X.99B8.BJJ-2016-1070.R1. |
| 25 |
Li Y, Guo Y, Li M, et al. Acetabular index is the best predictor of late residual acetabular dysplasia after closed reduction in developmental dysplasia of the hip[J]. Int Orthop, 2018, 42(3): 631-640. DOI:10.1007/s00264-017-3726-5. |
| 26 |
Alassaf N. Prediction of the requirement of open reduction for developmental dysplasia of the hip[J]. J Int Med Res, 2018, 46(1): 54-61. DOI:10.1177/0300060517717357. |
| 27 |
Sankar WN, Gornitzky AL, Clarke NM, et al. Closed reduction for developmental dysplasia of the hip:early-term results from a prospective, multicenter cohort[J]. J Pediatr Orthop, 2016. DOI:10.1097/BPO.0000000000000895. |
| 28 |
Schur MD, Lee C, Arkader A, et al. Risk factors for avascular necrosis after closed reduction for developmental dysplasia of the hip[J]. J Child Orthop, 2016, 10(3): 185-192. DOI:10.1007/s11832-016-0743-7. |
| 29 |
Ramo BA, De La Rocha A, Sucato DJ, et al. A new radiographic classification system for developmental hip dysplasia is reliable and predictive of successful closed reduction and late pelvic osteotomy[J]. J Pediatr Orthop, 2018, 38(1): 16-21. DOI:10.1097/BPO.0000000000000733.. |
 2018, Vol. 17
2018, Vol. 17


