儿童脑肿瘤已经超过儿童白血病,成为发病率和病死率均居首位的儿童肿瘤[1]。髓母细胞瘤(medulloblastoma, MB)是最常见的儿童恶性脑肿瘤,被世界卫生组织(World Health Organization, WHO)定为Ⅳ级肿瘤[2]。目前临床根据患儿年龄,肿瘤有无播散、切除程度以及病理亚型进行危险分层[3]。近年又根据基因分型将MB分为四个亚型(WNT、SHH、Group 3和Group 4),各亚型生物学特征和预后各不相同[4]。Ramaswamy等[5]在分子亚型的基础上提出了最新的危险分层。有研究表明,细胞增殖指数与无进展生存率、整体生存率密切相关[6]。Ki-67蛋白一直被广泛用作人类肿瘤细胞增殖的标志物,其存在于细胞周期所有活跃阶段(G1期,S期,G2期和有丝分裂期),但在静止期(G0期)细胞中不存在[7]。在乳腺癌、膀胱癌患者中,Ki-67已被证明是评价预后的重要指标[8-9]。国内多项研究发现,Ki-67的表达量是成人MB预后的独立影响因素[10-11]。而在儿童(<18岁)MB中,Ki-67与患儿预后的关系还未见报道。本研究中我们收集MB患儿临床病理资料,旨在评估Ki-67指数与MB患儿预后之间的关联性。
材料与方法 一、临床资料以2006年1月至2015年12月上海交通大学医学院附属新华医院收治的103例MB患儿为研究对象,收集患儿年龄、性别、组织病理分型、Ki-67指数(术后病理报告中的Ki-67表达量)、影像学特征(肿瘤位置、大小、有无转移)、手术切除程度(根据手术记录和术后72 h内MRI结果)分为全切或近全切(术后磁共振显示:肿瘤无残留或残留<1.5 cm2),次全切除(术后磁共振显示肿瘤残余超过1.5 cm2)两类、生存时间(从手术到死亡或随访截止时间)、术后转移或复发时间(从手术到发现转移灶或复发灶的时间)、放疗和化疗情况等[12]。本研究经上海交通大学医学院附属新华医院伦理委员会审核批准(XHEC-D-2022-144)。
二、入组标准纳入标准:①经术前影像学检查及术后病理结果确诊为MB并行Ki-67检测;②存在原发肿瘤;③年龄≤18岁。排除标准:①围术期死亡;②随访期间非肿瘤原因导致死亡;③随访时间少于5年。
三、组织分子病理组织学分型:按照2016版WHO中枢神经系统肿瘤分类标准,分为经典型MB (classic medulloblastoma, CMB)、结缔组织增生或结节型(desmoplastic/nodular medulloblastoma, DMB)、广泛结节型(medulloblastoma with extensive nodularity, MBEN)、大细胞/间变型(large cell and anaplastic medulloblastoma, LC/A)以及NOS未分类肿瘤[12-14]。
四、Ki-67染色及计数由本院病理科进行Ki-67的免疫组织化学检测。细胞核有黄色沉着为Ki-67阳性细胞。选取5个不同高倍镜视野, 分别计数500个细胞, 计算Ki-67阳性细胞数占总细胞数的百分比。
五、随访内容术后每3个月随访1次头部增强MRI、每6个月随访1次头部和全脊椎增强MRI;或出现新发症状(头痛、呕吐、腰痛、四肢无力等)的情况下及时行头颅和全脊椎增强MRI,观察有无肿瘤复发和转移。通过电话、门诊等方式对患儿进行随访。按照预后情况分为存活组和死亡组、进展组和非进展组。
随访开始日期为2006年1月1日,截止日期为2020年12月31日,并计算预后相关指标,包括:①总体生存时间(overall survival,OS):从手术到死亡或截至随访的时间;②总体无进展生存时间(progression free survival,PFS):从手术到疾病出现进展(包括转移、复发、死亡)或截至随访的时间。
六、统计学处理使用SPSS 21进行统计学分析(图 1)。分类变量以相对数、构成比或率(%)表示;对符合正态分布的连续变量采用独立样本t检验;使用Kaplan-Meier方法构建生存曲线,使用Log-rank检验(单因素分析)分析各亚组之间OS和PFS的差异。单变量分析中有统计学意义的因素被放入Cox比例风险回归模型中。P<0.05为差异有统计学意义。
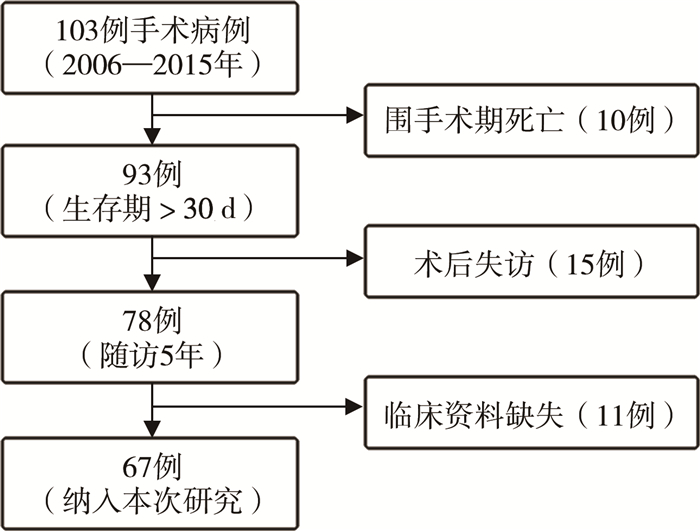
|
图 1 儿童髓母细胞瘤病例纳入流程图 Fig.1 Flow chart of included cases |
根据入组标准,103例患儿中67例最终纳入分析(图 1),67例MB患儿年龄(5.24±2.94)岁,年龄最小1.03岁,最大11.56岁;<5岁31例(31/67,46.27%),≥5岁36例(36/67,53.73%);男49例(49/67,73.13%),女18例(18/67,26.87%)。主要临床症状包括头痛、呕吐、共济失调、眼球震颤、颅神经麻痹、头围增大等。依据Chang氏分期标准,M(0)期56例(56/67,83.58%),M(+)期11例(11/67,16.42%)。MB位于小脑蚓部22例(22/67,32.84%),四脑室42例(42/67,62.69%),小脑半球3例(3/67,4.48%)。经典型45例(45/67,67.16%),促纤维增生/结节型7例(7/67,10.45%),伴广泛结节型5例(5/67,7.46%),大细胞/间变型1例(1/67,1.49%),未分类9例(9/67,13.43%)。
67例患儿中54例有新鲜冷冻肿瘤组织标本,对该54例标本进行RNA-seq测序,37例质检合格(37/54,68.52%),根据RNA-seq检查结果,其中WNT 1例(1/37,2.7%),SHH 8例(8/37,21.62%),Group3 10例(10/37,27.03%),Group4 12例(12/37,32.43%),Group3-Group4 6例(6/37,16.22%);未分类30例(30/67,44.78%)。
肿瘤全切63例(63/67,94.03%),大部切除4例(4/67,5.97%);术前有脑积水症状经手术干预37例(37/67,55.22%),保守治疗30例(30/67,44.78%);术后行化疗53例(53/67,79.10%),未行化疗14例(14/67,20.90%);放疗55例(55/67,82.09%),未放疗12例(12/67,17.91%)。见表 1。
| 表 1 67例MB患儿5年总体生存时间和总体无进展生存时间影响因素的单因素分析 Table 1 Univariate analysis of prognostic factors for OS/EFS in 67 MB children |
|
|
Ki-67阳性指数为(34.85±16.72)%,范围5.00%~90.00%。按患儿预后及肿瘤进展分组统计,存活组为(30.53±13.24)%,死亡组为(40.52±19.20)%;进展组为(31.50±12.94)%,未进展组为(37.57±18.99)%;存活组和死亡组Ki-67表达量差异有统计学意义(P=0.01),进展组与未进展组Ki-67表达量差异无统计学意义(P=0.14)。根据ROC曲线计算Ki-67的最佳临界值为35%,以此为界,将Ki-67分为两组:Ki-67<35%为低表达组,30例(30/67,44.78%);Ki-67≥35%为高表达组,37例(37/67,55.22%)。
三、MB预后情况及相关因素67例患儿术后5年随访中,30例无进展生存(PFS: 44.78%),38例存活(OS: 56.72%),患儿随访时间为(60±35.06)个月,复发转移时间为术后(11.93±12.44)个月。单因素生存分析结果显示:组织病理分型、术后放疗和化疗与术后转移、复发有关(P<0.05),见图 2;Ki-67表达量、术后放疗和化疗与总体生存时间有关(P<0.05),见图 3。多因素生存分析显示:放疗是术后转移、复发的独立影响因素(P<0.05);Ki-67表达量和术后放疗是患儿整体生存时间的独立影响因素(P<0.05),见表 2。
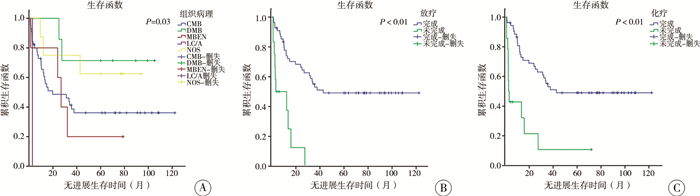
|
图 2 MB患儿PFS生存曲线图 Fig.2 Univariate analysis of PFS survival curves A: 组织病理与PFS的关系(P=0.03);B: 放疗与PFS的关系(P<0.01);C: 化疗与PFS的关系(P<0.01) 注 MB:髓母细胞瘤; PFS: 无进展生存时间 |
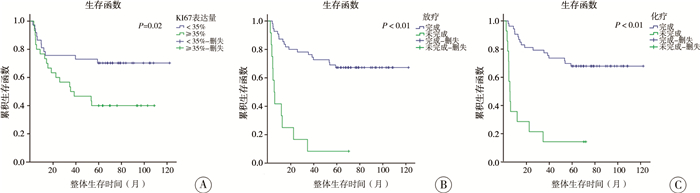
|
图 3 MB患儿OS生存曲线 Fig.3 Univariate analysis of OS (overall survival time) survival curve A: Ki-67与OS的关系(P=0.02);B: 放疗与OS的关系(P<0.01);C: 化疗与OS的关系(P<0.01) 注 MB:髓母细胞瘤; OS: 总体生存时间 |
| 表 2 MB患儿OS影响因素的多因素分析 Table 2 Multivariate analysis of prognostic factors for OS in MB children |
|
|
MB是一种复杂的异质性疾病,具有不同的组织学类型和不同的生物学临床特征。近几年来,分子分型在MB患儿的个性化精准治疗中扮演着极其重要的角色。然而由于分子病理检测费用高、周期长,目前仍处临床试验阶段。
目前根据患儿年龄、术前有无转移、手术切除范围、组织病理分类将髓母细胞瘤患儿分为标危组和高危组[3]。2015年新疆医科大学通过对85例髓母细胞瘤进行研究,发现间变型髓母细胞瘤Ki-67的表达比其他类型髓母细胞瘤高,说明Ki-67表达与髓母细胞瘤组织病理分类有关[23]。Ki-67指数作为重要的增殖标志物之一,与多种肿瘤的预后有关[8-9]。而在儿童MB中,Ki-67指数的预后意义存在争议。有研究者认为,Ki-67指数高与MB患儿预后不良相关,而其他研究则否认Ki-67指数会影响MB患者预后,这种分歧可能与选择Ki-67表达量的临界值不同有关[15-18]。Ki-67是由MKI67基因编码的核蛋白,在细胞周期、细胞增殖和核糖体RNA转录中起关键作用[19]。细胞在进行有丝分裂时,Ki-67负责维持染色体分散于细胞质中,它主要覆盖在有丝分裂时期染色体的表面,主要与超螺旋DNA和AT-富集区DNA结合[20]。Ki-67通常在细胞分裂的G1晚期、S期、G2期和M期表达,在G0期不能检测到Ki-67蛋白,而在G2期,Ki-67蛋白在有丝分裂过程中高表达[21]。除此之外,Ki-67还常用作疗效的药理动力学标志,尤其是在接受化疗的乳腺癌患者中[22]。
本研究中,Ki-67阳性表达高于35%为高Ki-67指数组,低于35%为低Ki-67组,高Ki-67指数组患儿(5年OS:51.35%,5年PFS:36.67%)比低Ki-67组患儿(5年OS:70.27%,5年PFS:40.00%)预后更差,但PFS差异没有统计学意义,与Zhao等[10]在成人MB(18~45岁)患者中的研究结果相似。因此,我们将Ki-67指数作为评估儿童MB预后的生物标志物。
本研究存在一定的局限性。首先,本研究为单中心回顾性研究,样本量少,难以消除偏倚因素;其次,本研究中未分析各分子亚型的预后,今后我们将扩大样本量,进一步结合分子病理和Ki-67指数,验证Ki-67表达量与儿童MB预后的关系。
本研究中67例髓母细胞瘤患儿5年PFS为44.78%,OS为56.72%,与华山医院治疗结果相似,而国外研究报道远高于国内的5年生存率,这也说明我国髓母细胞瘤的诊治尚处于相对落后状态[5, 24]。因此,2017年5月,本研究中心牵头成立了中国儿童脑肿瘤协助组,开展国内多中心髓母细胞瘤临床回顾性研究,这将有助于规范儿童、青少年脑肿瘤的综合治疗,促进其基础研究和临床研究的发展。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 文献检索为梁壮壮、曹亮亮,论文调查设计为王佳甲、马杰, 数据收集与分析梁壮壮、赵恒, 论文结果撰写为梁壮壮、赵阳、王保成, 论文讨论分析为梁壮壮、马杰
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1): 7-30. DOI:10.3322/caac.21332 |
| [2] |
Liu X, Ding C, Tan W, et al. Medulloblastoma: molecular understanding, treatment evolution, and new developments[J]. Pharmacol Ther, 2020, 210: 107516. DOI:10.1016/j.pharmthera.2020.107516 |
| [3] |
中国抗癌协会小儿肿瘤专业委员会. 儿童髓母细胞瘤多学科诊疗专家共识(CCCG-MB-2017)[J]. 中国小儿血液与肿瘤杂志, 2018, 23(4): 169-174. Committee of Pediatrics, Chinese Anti-Cancer Association. Multidisciplinary therapists Consensus on Pediatric Medulloblastoma[J]. Journal of China Pediatric Blood and Cancer, 2018, 23(4): 169-174. DOI:10.3969/j.issn.1673-5323.2018.04.001 |
| [4] |
Kool M, Korshunov A, Remke M, et al. Molecular subgroups of medulloblastoma: an international meta-analysis of transcriptome, genetic aberrations, and clinical data of WNT, SHH, Group 3, and Group 4 medulloblastomas[J]. Acta Neuropathol, 2012, 123(4): 473-484. DOI:10.1007/s00401-012-0958-8 |
| [5] |
Ramaswamy V, Remke M, Bouffet E, et al. Risk stratification of childhood medulloblastoma in the molecular era: the current consensus[J]. Acta Neuropathol, 2016, 131(6): 821-831. DOI:10.1007/s00401-016-1569-6 |
| [6] |
Shim KW, Joo SY, Kim SH, et al. Prediction of prognosis in children with medulloblastoma by using immunohistochemical analysis and tissue microarray[J]. J Neurosurg Pediatr, 2008, 1(3): 196-205. DOI:10.3171/PED/2008/1/3/196 |
| [7] |
Sun X, Kaufman PD. Ki-67:more than a proliferation marker[J]. Chromosoma, 2018, 127(2): 175-186. DOI:10.1007/s00412-018-0659-8 |
| [8] |
Nielsen TO, Leung S, Rimm DL, et al. Assessment of ki67 in breast cancer: updated recommendations from the international ki67 in breast cancer working group[J]. J Natl Cancer Inst, 2021, 113(7): 808-819. DOI:10.1093/jnci/djaa201 |
| [9] |
Tian Y, Ma Z, Chen Z, et al. Clinicopathological and prognostic value of ki-67 expression in bladder cancer: a systematic review and meta-analysis[J]. PLoS One, 2016, 11(7): e0158891. DOI:10.1371/journal.pone.0158891 |
| [10] |
Zhao F, Zhang J, Li P, et al. Prognostic value of Ki-67 index in adult medulloblastoma after accounting for molecular subgroup: a retrospective clinical and molecular analysis[J]. J Neurooncol, 2018, 139(2): 333-340. DOI:10.1007/s11060-018-2865-x |
| [11] |
李克, 耿俊杰, 张振宇, 等. Ki-67表达对髓母细胞瘤患者预后的影响[J]. 中国实用医刊, 2019, 46(11): 1-3. Li K, Geng JJ, Zhang ZY, et al. Influence of Ki-67 on the prognosis of patients with medulloblastoma[J]. Chinese Journal of Practical Medicine, 2019, 46(11): 1-3. DOI:10.3760/cma.j.issn.1674-4756.2019.11.001 |
| [12] |
Thompson EM, Hielscher T, Bouffet E, et al. Prognostic value of medulloblastoma extent of resection after accounting for molecular subgroup: a retrospective integrated clinical and molecular analysis[J]. Lancet Oncol, 2016, 17(4): 484-495. DOI:10.1016/S1470-2045(15)00581-1 |
| [13] |
Louis DN, Perry A, Reifenberger G, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary[J]. Acta Neuropathol, 2016, 131(6): 803-820. DOI:10.1007/s00401-016-1545-1 |
| [14] |
Chang CH, Housepian EM, Herbert C Jr. An operative staging system and a megavoltage radiotherapeutic technic for cerebellar medulloblastomas[J]. Radiology, 1969, 93(6): 1351-1359. DOI:10.1148/93.6.1351 |
| [15] |
余建忠, 施伟, 赵瑞, 等. 儿童髓母细胞瘤的临床特点及预后相关因素分析[J]. 临床小儿外科杂志, 2020, 19(3): 236-240, 247. Yu JZ, Shi W, Zhao R, et al. Clinical characteristics and prognostic factors of pediatric medulloblastoma[J]. J Clin Ped Sur, 2020, 19(3): 236-240, 247. DOI:10.3969/j.issn.1671-6353.2020.03.009 |
| [16] |
Nam DH, Wang KC, Kim YM, et al. The effect of isochromosome 17q presence, proliferative and apoptotic indices, expression of c-erbB-2, bcl-2 and p53 proteins on the prognosis of medulloblastoma[J]. J Korean Med Sci, 2000, 15(4): 452-456. DOI:10.3346/jkms.2000.15.4.452 |
| [17] |
Son EI, Kim IM, Kim DW, et al. Immunohistochemical analysis for histopathological subtypes in pediatric medulloblastomas[J]. Pathol Int, 2003, 53(2): 67-73. DOI:10.1046/j.1440-1827.2003.01444.x |
| [18] |
Woodburn RT, Azzarelli B, Montebello JF, et al. Intense p53 staining is a valuable prognostic indicator for poor prognosis in medulloblastoma/central nervous system primitive neuroectodermal tumors[J]. J Neurooncol, 2001, 52(1): 57-62. DOI:10.1023/a:1010691330670 |
| [19] |
Cuylen S, Blaukopf C, Politi AZ, et al. Ki-67 acts as a biological surfactant to disperse mitotic chromosomes[J]. Nature, 2016, 535(7611): 308-312. DOI:10.1038/nature18610 |
| [20] |
MacCallum DE, Hall PA. The biochemical characterization of the DNA binding activity of pKi67[J]. J Pathol, 2000, 191(3): 286-298. DOI:10.1002/1096-9896(2000)9999:9999<::AID-PATH628>3.0.CO;2-J |
| [21] |
Gerdes J, Lemke H, Baisch H, et al. Cell cycle analysis of a cell proliferation-associated human nuclear antigen defined by the monoclonal antibody Ki-67[J]. J Immunol, 1984, 133(4): 1710-1715. |
| [22] |
D'cunja J, Shalaby T, Rivera P, et al. Antisense treatment of IGF-IR induces apoptosis and enhances chemosensitivity in central nervous system atypical teratoid/rhabdoid tumours cells[J]. Eur J Cancer, 2007, 43(10): 1581-1589. DOI:10.1016/j.ejca.2007.03.003 |
| [23] |
苗娜, 楚慧, 王志强, 等. 85例髓母细胞瘤临床病理学分析[J]. 新疆医科大学学报, 2015, 38(1): 77-79. Miao N, Chu H, Wang ZQ, et al. Clinicopathological ananlysis of 85 cases with medulloblastoma[J]. Journal of Xinjiang Medical University, 2015, 38(1): 77-79. DOI:10.3969/j.issn.1009-5551.2015.01.020 |
| [24] |
Zhang ZY, Xu J, Ren Y, et al. Medulloblastoma in China: clinicopathologic analyses of SHH, WNT, and non-SHH/WNT molecular subgroups reveal different therapeutic responses to adjuvant chemotherapy[J]. PLoS One, 2014, 9(6): 1932-6203. DOI:10.1371/journal.pone.0099490 |
 2022, Vol. 21
2022, Vol. 21


