先天性胃壁肌层缺损可导致新生儿急腹症,虽然发生率较低,但一旦发病进展迅速,且具有较高的病死率[1]。外科手术是其唯一的治疗手段,术后常需长时间禁食,但国外文献表明长时间禁食更容易导致患者肠黏膜萎缩,使肠道细菌易位,引起肠源性感染,因此早期肠内营养对维持消化道的正常结构及生理功能至关重要[2-4]。近年来随着空肠营养管的广泛应用,早期肠内营养也开始逐渐应用到上消化道手术后的营养补给中,本研究将以先天性胃壁肌层缺损的手术患者为研究对象,根据术中是否留置空肠营养管分为早期肠内营养组和常规喂养组,比较两组的临床疗效。
材料与方法 一、临床资料以2003年6月至2018年6月汕头大学医学院第二附属医院收治的23例先天性胃壁肌层缺损患者为研究对象,其纳入标准:①术中及术后病理均确诊为胃壁肌层缺损(图 1、图 2);②术中未发现其他先天性消化道畸形(包括肠穿孔)。其中2003年6月至2012年6月收治的11例胃壁肌层缺损患者为常规喂养组(术中未留置空肠营养管),其中男性6例,女性5例,胎龄(35.96±0.68)周,入院时体重(2.65±0.65)kg;2012年7月至2018年6月收治的12例胃壁肌层缺损患者为早期肠内营养组(术中经鼻留置空肠营养管,尾端通过屈氏韧带15 cm以上,并固定于鼻翼以防脱落),其中男性7例,女性5例,胎龄(36.14±0.67)周,入院时体重(2.8±0.6)kg。两组患者胎龄、入院时体重差异均无统计学意义(P>0.05),具有可比性。
|
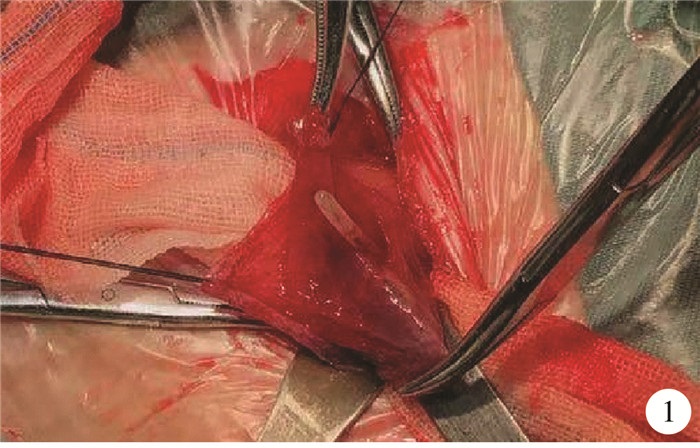
图 1 先天性胃壁肌层缺损患者术中图片(可见胃窦部全层裂开,胃管自胃腔突出) Fig.1 Intraoperative image |

|
图 2 先天性胃壁肌层缺损患者术后坏死胃壁病理切片(采用HE染色,切片可见胃壁肌层缺失,仅见胃黏膜及黏膜下层) Fig.2 Pathological sections of postoperative necrotic gastric wall |
23例均急诊行先天性胃壁坏死肌层切除、胃壁缺损修补术。两组术前、术后均给予抗生素及肠外营养干预。肠外营养方案主要由氨基酸、脂肪乳及葡萄糖组成,氨基酸起始剂量为1 g·kg-1·d-1,每日增加量为0.5 g/kg;脂肪乳的起始剂量为0.5 g·kg-1·d-1,每日增加量为0.5 g/kg;葡萄糖起始量为8 mg·kg-1·min-1,逐步增加;每日供能总量最终达60~80 kcal·kg-1·d-1。
1. 早期肠内营养组:术后第3天开始由空肠营养管注入温葡萄糖水(每次0.5~2 mL),间隔6 h,根据肠道耐受性逐步增加,速度一般为2~3 mL·kg-1·d-1,增加总量不超过10 mL/d,至鼻饲温葡萄糖水达20~30 mL·kg-1·d-1后改为配方奶鼻饲,最终经奶瓶全量喂养,总奶量达140~150 mL·kg-1·d-1。
2. 常规喂养组:术后第7天开始鼻饲配方奶,每次2~5 mL/kg,间隔3 h,以后按照10~20 mL·kg-1·d-1的速度增加,最终经奶瓶全量喂养,总奶量达140~150 mL·kg-1·d-1。
3. 观察指标:治疗期间每周测一次体重,应用美国贝克曼库尔特全自动血细胞分析仪(型号LH780)检测血常规各项指标,采用全自动生化分析仪(型号AV5400)检测肝功能及生化指标,采用全自动血气分析仪(型号GEM3000)测定血清pH值。同期记录首次排便时间,并针对两组患者术前及术后1周电解质(K+、Na+、Ca2+)及酸碱平衡、营养指标(体重、血红蛋白、血清白蛋白、载脂蛋白)、首次排便时间、吻合口瘘和病死率进行对比。
三、统计分析采用SPSS17.0进行统计学分析。本研究中的计量指标均服从或近似服从正态分布,故采用(x±s)进行描述,两组间对比采用独立样本t检验,同一组间干预前后对比采用配对t检验;计数指标采用率、构成比进行统计学描述,采用χ2检验或Fisher精确概率法进行组间比较。P<0.05认为差异具有统计学意义。
结果两组术前均有不同程度的电解质紊乱及酸碱失衡,但差异无统计学意义(P>0.05),术后7 d早期肠内营养组患者血K+、Ca2+水平及pH值与常规喂养组比较差异有统计学意义(P<0.05)。
早期肠内营养组体重增长较快,与常规喂养组比较差异有统计学意义(P<0.05),而两组术后1周其它营养指标(血红蛋白、血清白蛋白、载脂蛋白A、载脂蛋白B)差异均无统计学意义(P>0.05)。见表 1。
| 表 1 两组患者术前术后各项血清学指标比较(x±s) Table 1 Comparing pre and postoperative status of two groups(x±s) |
|
|
早期肠内营养组首次排便时间短于常规喂养组,差异有统计学意义(P<0.05)。早期肠内营养组无一例吻合口瘘,1例因脓毒症合并DIC于术后第2天死亡;常规喂养组发生1例吻合口瘘,并发脓毒症于术后第5天死亡(2例死亡病例仅纳入吻合口瘘及病死率数据进行统计,未纳入其他指标)。两组吻合口瘘发生率及病死率差异均无统计学意义(P>0.05)。见表 2。
| 表 2 两组患者术后首次排便时间及术后情况比较 Table 2 Comparing initial defecating time and general postoperative status of two groups |
|
|
由于先天性胃壁肌层缺损的患者均为新生儿,能量储备少,加上手术创伤、术中失血等因素,造成患者机体处于应激状态,能量消耗增大,蛋白质分解增加,机体处于高度营养风险状态[5, 6]。术后营养支持能为机体在应激状态下提供足够的能量,加快康复进程。
国外有学者通过对复合胃肠动力波的研究, 提出腹部手术后24 h内肠内营养的概念,为小儿腹部手术后早期肠道营养提供初步的理论依据[7, 8]。国内也有研究者提出患者在消化道手术后会度过48~72 h的水肿期,待吻合口黏膜初步愈合后再经空肠营养管进行管饲可能更有利于患者康复[9]。考虑到治疗的安全性以及目前成熟的全静脉营养技术,因此本研究选择术后第3天进行早期肠内营养。
机体内电解质和酸碱平衡状况是影响新生儿术后恢复的重要因素。先天性胃壁肌层缺损发作时伴有大量消化液进入腹腔,造成弥漫性腹膜炎,加上手术打击,患者极易发生电解质紊乱[10]。新生儿早期给予少量肠内喂养可以增加胰岛素样生长因子分泌, 进而影响葡萄糖转运和代谢, 保持Na+-K+-ATP和Na+-H+-ATP酶活性,有利于术后机体维持Na+-K+及酸碱平衡[11]。新生儿对血钙的调节能力差,而血钙调节主要由细胞膜上的钙泵完成,钙泵需要消耗一定的能量来保持钙离子的浓度梯度。早期肠内营养能提供机体更好的能量支持,有助于调节细胞内外钙离子浓度,同时可促进肠绒毛的成熟,提高胃肠的耐受性,调节肠道对Ca2+的吸收与排泄[12]。本研究中,两组病例术前均存在不同程度的电解质紊乱及酸碱失衡。早期肠内营养组患者在常规静脉营养基础上给予早期微量喂养, 机体电解质紊乱得到有效纠正, 患者血K+、Ca2+水平与常规喂养组比较差异有统计学意义(P < 0.05)。两组患者的酸碱失衡较术前均有改善,但早期肠内营养组的pH值波动范围较小,且未出现碱中毒,两组差异有统计学意义(P < 0.05),说明早期肠内营养能更好地维持患者机体电解质及酸碱平衡。
新生儿营养状态可采用多种指标进行评估,如肱三头肌皮肤皱褶厚度、中臂周长、Hb、ALB和Apo等[13, 14]。本次研究对两组患者的Hb、ALB、ApoA和ApoB进行对比分析,但差异均没有统计学意义。Hb、AlB的半衰期分别为120 d、18 d,而过长的半衰期可能无法直观反映患者即刻营养状态,因此可能造成两组间差异不够显著。ApoA、ApoB虽然是大型手术后评估营养状况的重要指标,但是先天性胃壁肌层缺损均在新生儿期发病,母体代谢情况、宫内发育程度、胎龄均可能间接影响患者载脂蛋白的水平,而本研究是回顾性分析,未能对孕期情况进行跟踪,故两组间ApoA和ApoB水平差异有可能被上述因素掩盖[15]。体重的增加表明患者的能量供应不仅可以维持机体的修复,还能满足自身生长的生理需求[16]。本研究发现早期肠内营养组的患者体重增长速度显著快于常规喂养组,提示早期微量肠内营养可加快患者体重增长进程,对术后营养恢复有一定帮助。首次排便时间是新生儿术后肠功能恢复的常用指标,本组中早期肠内营养组首次排便时间更早,与常规喂养组比较差异有统计学意义,说明早期肠内营养有助于新生儿创伤后肠道功能的恢复。
先天性胃壁肌层缺损术后吻合口瘘的发生主要与坏死胃壁组织切除不完全、吻合口供血不足、术后严重的全身感染有关[17]。本组中早期肠内营养组采用空肠营养管通过全胃后置于十二指肠或空肠进行喂养,避免了早期营养液对吻合口愈合过程中造成的不良影响,故早期肠内营养组未发现吻合口瘘。多数专家认为先天性胃壁肌层缺损术后死亡的主要原因包括低出生体重、术后合并感染及其他畸形[18, 19]。本研究中2例术后死亡原因分别为脓毒症、弥散性血管内凝血,与患者术前病程较长、感染严重、就诊不及时有关。
总之,先天性胃壁肌层缺损的诊治要点是早发现、早治疗。早期微量肠内营养对先天性胃壁肌层缺损术后康复进程的加速有一定帮助,并有助于维持机体电解质及酸解平衡。
| [1] |
郑锦涛, 唐华建, 刘国庆, 等. 9例先天性胃壁肌层缺损诊疗报告[J]. 赣南医学院学报, 2015, 35(3): 396-397. Zheng JT, Tang HJ, Liu GQ, et al. Diagnosis and treatment of 9 cases of congenital defects of gastric musculature[J]. Journal of Gannan Medical University, 2015, 35(3): 396-397. DOI:10.3969/j.issn.1001-5779.2015.03.020 |
| [2] |
Jirapaet K, Jirapaet V, Sritipsukho S. Safety of initiating early enteral feeding with slow volume advancement in preterm infants[J]. J Med Assoc Thai, 2010, 93(10): 1170-1187. |
| [3] |
Salhotra A, Ramji S. Slow versus fast enteral feed advancement in very low birth weight infants: a randomized control trial[J]. Indian Pediatr, 2004, 41(5): 435-441. |
| [4] |
Mcclave SA, Chang WK, Dhaliwal R, et al. Nutrition support in acute pancreatitis: a systematic review of the literature[J]. J Parenter Enteral Nutr, 2006, 30(2): 143-156. DOI:10.1177/0148607106030002143 |
| [5] |
Hu B, Ye H, Sun C, et al. Metoclopramids or domperidone improves postpyloric placement of spiral nasojejunal tubes in critically ill patients: a prospective multicenter open-label randomized controlled clinical trial[J]. Crit Care, 2015, 19(1): 61. DOI:10.1186/s13054-015-0784-1 |
| [6] |
Jiang W, Lv X, Xu X, et al. Early nutrition for upper digestive tract malformation in neonate[J]. Asia Pac J Clin Nut, 2015, 24(1): 38-43. DOI:10.6133/apjcn.2015.24.1.08 |
| [7] |
Sanghvi KP, Joshi P, Nabi F, et al. Feasibility of exclusive enteral feeds from birth in VLBW infants>1200 g-an RCT[J]. Acta Paediatr, 2013, 102(7): 299-304. DOI:10.1111/apa.12254 |
| [8] |
Nicholas DE, Robert JT. Enteral feeds in preterm infants: starting and increasing[J]. Paediatrics and Child Health, 2011, 21(10): 476-477. DOI:10.1016/j.paed.2011.07.004 |
| [9] |
戚继荣, 莫绪明, 钱龙宝, 等. 早期微泵肠内营养输注对新生儿食管闭锁临床预后的研究[J]. 中华小儿外科杂志, 2014, 35(3): 195-198. Qi JR, Mo XM, Qian LB, et al. Early enteral nutrition infusion micropump supports for neonate esophageal atresia[J]. Chin J Pediatr Surg, 2014, 35(3): 195-198. DOI:10.3760/cma.j.issn.0253-3006.2014.03.009 |
| [10] |
张敕, 朱慧. 早期胃肠外营养方案对超低出生体重儿电解质紊乱的影响分析[J]. 当代医学, 2017, 23(25): 50-52. Zhang C, Zhu H. The early parenteral nutrition solution for low birth weight impact analysis of electrolyte disorder[J]. Contemporary Medicine, 2017, 23(25): 50-52. DOI:10.3969/j.issn.1009-4393.2017.25.021 |
| [11] |
陈春, 崔银珠, 张谦慎. 早期胃肠外营养方案对超低出生体重儿电解质的影响[J]. 中国新生儿科杂志, 2012, 27(6): 394-397. Chen C, Cui YZ, Zhang QS. The effect of early parenteral nutrition on preventing electrolyte imbalance within 72 hour after birth in extremely low birth weight infants[J]. Chinese Journal of Neonatology, 2012, 27(6): 394-397. DOI:10.3969/j.issn.1673-6710.2012.06.009 |
| [12] |
Stephens BE, Walden RV, Gargus RA, et al. First-week protein and energy intakes are associated with18-month developmental outcomes in extremely low birth weight infants[J]. Pediatrics, 2009, 123(5): 1337-1343. DOI:10.1542/peds.2008-0211 |
| [13] |
Aroor AR, Krishnan L, Reyes Z, et al. Early versus Late Parenteral Nutrition in Very Low Birthweight Neonates: A retrospective study from Oman[J]. Sultan Qaboos Univ Med J, 2012, 12(1): 33-40. DOI:10.12816/0003085 |
| [14] |
Savran B, Adiguzel U, Yuksel KB, et al. The importance of antenatal diagnosis of congenital duodenal obstruction[J]. Ir J Med Sci, 2016, 185(3): 695-698. DOI:10.1007/s11845-015-1345-y |
| [15] |
Katsuramaki T, Mizuguchi T, Kawamoto M. 肝切除术后血清载脂蛋白(apolipoprotein A-1, apoA)水平评估营养状况以及预测术后肝功能[J]. 中华肝胆外科杂志, 2007, 13(8): 518. Katsuramaki T, Mizuguchi T, Kawamoto M. Serum apolipoprotein A-1(apoA) levels after hepatectomy assess nutritional status and predict postoperative liver function[J]. Chinese Journal of Hepatobiliary Surgery, 2007, 13(8): 518. |
| [16] |
Singh V, Pathak M. Congenital Neonatal Intestinal Obstruction: Retrospective Analysis at Tertiary Care Hospital[J]. J Neonatal Surg, 2016, 5(4): 49. DOI:10.21699/jns.v5i4.393 |
| [17] |
曹慧, 张宏伟, 刘丰丽, 等. 新生儿先天性胃壁肌层缺损胃穿孔25例[J]. 临床小儿外科杂志, 2010, 9(5): 369-370. Cao H, Zhang HW, Liu FL, et al. Neonatal perforation of congenital defects of gastric musculature in 25 case[J]. J Clin Ped Sur, 2010, 9(5): 369-370. DOI:10.3969/j.issn.1671-6353.2010.05.019 |
| [18] |
耿其明, 吕小逢, 张杰, 等. 经鼻留置空肠营养管在新生儿高位消化道畸形矫治中的应用[J]. 临床小儿外科杂志, 2014, 13(3): 238-241, 249. Geng QM, Lv XF, Zhang J, et al. A new transnasal approach of the placement of jejuna feeding tube intraoperatively for upper digestive tract malformation newborn[J]. J Clin Ped Surg, 2014, 13(3): 238-241, 249. |
| [19] |
王志强, 谢丽微, 吴红芳, 等. 新生儿自发性胃穿孔临床病理特点和病因探讨[J]. 中华儿科杂志, 2010, 48(10): 779-782. Wang ZQ, Xie LW, Wu HF, et al. Clinicopathological characteristics and potential etiologies of neonatal spontaneous gastric perforation[J]. Chinese Journal of Pediatrics, 2010, 48(10): 779-782. DOI:10.3760/cma.j.issn.0578-1310.2010.10.015 |
 2021, Vol. 20
2021, Vol. 20


