肝母细胞瘤是儿童常见恶性实体肿瘤之一,在治疗过程中,外科手术仍是重要的组成部分[1]。近年来,随着肝母细胞瘤的手术技术和围手术期管理的不断进步,手术风险及死亡率大大降低,然而手术并发症仍影响着患儿的生存和预后,其中胆瘘是肝母细胞瘤手术后常见的并发症之一[2-5]。胆瘘的存在通常可导致住院时间延长、腹腔引流管拔除延迟、术后化疗延误,增加了额外的治疗和创伤,还可诱发多种严重并发症(如重症感染、肠梗阻、胆管炎、梗阻性黄疸,甚至肝硬化和肝衰竭),因此临床上及时发现并治疗胆瘘尤为重要[6-8]。本文旨在总结儿童肝母细胞瘤手术后胆瘘的临床表现及治疗经验,从而提高临床对胆瘘的认识及诊疗水平。
材料与方法 一 研究对象选择2016年5月至2020年3月于首都医科大学附属北京儿童医院肿瘤外科行手术治疗的90例肝母细胞瘤患儿为研究对象,根据国际肝脏外科研究小组对胆瘘的判定标准,最终筛选出12例胆瘘患儿[3]。胆瘘的定义为:术后第3天或之后腹腔引流液中的胆红素浓度至少是血清胆红素浓度的3倍;或由于腹腔内胆汁聚集或胆汁性腹膜炎需要进行介入或手术治疗的患儿。该研究已通过本院医学伦理委员会批准。
二 研究方法通过查阅病历收集患儿的一般信息、临床特征、相关影像学检查结果、肝母细胞瘤切除术的手术情况、胆瘘的临床表现、胆瘘继发的并发症以及胆瘘的治疗措施。根据国际小儿肿瘤学会制定的PRETEXT(PRE-Treatment EXTent of disease)分期对患儿进行肿瘤术前分期[9]。根据术前影像学结果及术中所见,描述肿瘤累及部位及与第一肝门关系。肿瘤和包裹性积液的大小取影像学结果所描述三径线中的最大值。
三 统计学方法采用JMP13.0对数据进行分析。正态分布的连续变量以(x±s)表示,非正态分布的连续变量以M(P25,P75)表示,分类变量以频数、率以及百分比表示。
结果 一 胆瘘患儿的临床特征12例中位年龄为2(1,2.3)岁,男7例,女5例。10例为原发肿瘤。PRETEXT分期:Ⅱ期3例、Ⅲ期5例、Ⅳ期2例;复发肿瘤2例,既往分期不详。12例中,肿瘤累及左外叶2例、左内叶6例、右前叶9例、右后叶10例、尾叶1例;8例肿瘤与第一肝门关系密切。除2例在复发灶切除术前未行化疗外,其余10例术前均进行规律化疗,原发肿瘤术前最大径中位数为8.6(7.7,10.3)cm。12例均在我科进行了肿瘤切除手术,10例原发肿瘤中,大部分(8例)行非解剖性肝叶或肝段切除术,仅有2例行解剖性半肝切除术;2例复发患儿肿瘤均位于既往手术创面,肿瘤最大径分别为1.2 cm和2.8 cm,故仅行超声引导下复发灶剜除术。11例手术涉及肝中叶,即累及左内叶和(或)右前叶,手术时行肝中叶切除或部分切除;1例肿瘤仅累及右后叶及尾叶,手术时未对肝中叶造成损伤。5例在术中进行了胆道造影,均未见胆瘘征象,其余患儿术中未做胆道造影。全部患儿在手术结束时均放置腹腔引流,以便术后监测。
二 胆瘘的临床表现、并发症及治疗方法 一 临床表现本组12例术后胆瘘发生的中位时间为术后第7(7, 8.3)天,术后胆瘘发生最快的1例术后第4天出现胆瘘;最迟的1例术后第13天出现胆瘘,治疗的中位时间为3.5(1.5, 7.1)个月。出现胆瘘后,诊断方式包括以下3种:①8例胆汁自腹腔引流管流出,检测引流液胆红素浓度证实为术后胆瘘;②3例胆汁在腹腔形成包裹性积液,超声引导下穿刺抽液证实;③1例胆瘘导致胆汁性腹膜炎,经腹腔穿刺及急诊腹腔引流手术证实。共有9例(包括1例行急诊腹腔引流术患儿)可在腹腔引流管检测到胆汁流出,引流量<50 mL时,引流液多为淡黄色;引流量在50至100 mL之间时,颜色变深,可为深黄色或淡绿色;引流量>100 mL时,则多为墨绿色。
二 并发症胆瘘可合并多种并发症。本研究中,大多数伴有包裹性积液(9例),其他并发症还包括局部感染(3例)、电解质紊乱(1例)、全身感染(2例)、梗阻性黄疸(1例)、肝硬度升高(1例)、胆汁性腹膜炎(1例)以及肠梗阻(1例)。
三 治疗方法本组12例中有10例(83.3%)通过非手术治疗治愈,其中3例经腹腔外引流治愈,4例经腹腔外引流和保守观察治疗治愈,3例经超声引导下穿刺抽液治愈。其余2例(16.7%)经非手术治疗无效后通过胆道重建手术治愈,其中1例首先尝试胆道修补术,但未成功。12例治疗策略见图 1。
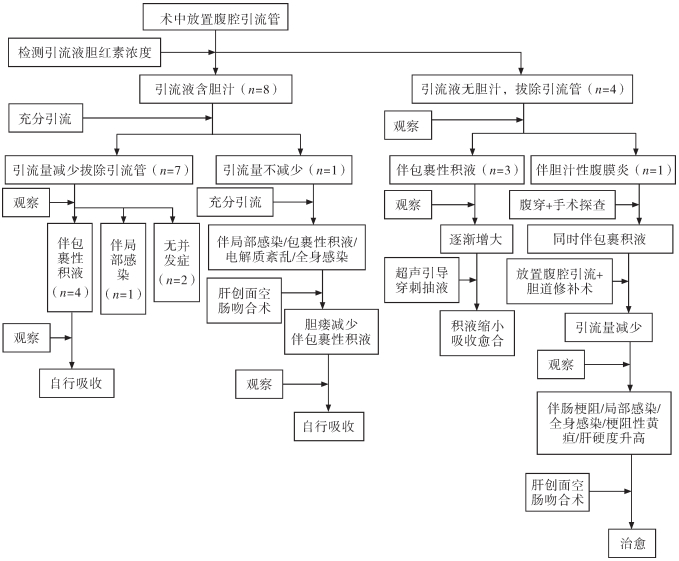
|
图 1 胆瘘患儿的治疗策略 Fig.1 Treatment strategies of pediatric biliary fistula |
7例胆汁自腹腔引流管流出,经过充分引流等对症治疗后,胆瘘逐渐减少愈合,拔除腹腔引流管,7例胆瘘量均<100 mL,其中2例未合并其他并发症,1例合并局部感染,4例拔管后出现包裹性积液,最大径分别为5.1 cm、6.1 cm、5.9 cm和6.8 cm,定期监测,积液逐渐缩小,自行吸收愈合。
另有3例在拔除腹腔引流后胆瘘形成包裹性积液,定期监测发现积液逐渐增多,最大径分别为6.6 cm、9.5 cm和10.7 cm,患儿没有出现胆汁性腹膜炎等其他并发症,故采用超声引导下穿刺抽液治疗,积液量均大幅度减少,并逐渐自行吸收愈合。以上10例胆瘘治愈后行规律术后化疗,虽然在发现胆瘘后进行了B超、CT及核磁共振等检查,但均无法明确具体胆瘘位置。
五 手术治疗1例胆汁自腹腔引流管流出,经过充分引流等对症治疗后,胆瘘量未减少,并出现局部感染、包裹性积液、电解质紊乱及全身感染,经过积极治疗控制病情,在胆瘘6个月后行胆道重建手术,术中胆瘘位置在既往手术创面,组织脆烂,故行肝创面空肠Roux-en-Y吻合术,术后胆瘘量逐渐减少,复查发现包裹性积液,最大径为5.8 cm,但患儿未出现胆汁性腹膜炎等其他并发症,定期监测发现积液逐渐减少,自行吸收治愈。
另有1例拔除腹腔引流管后出现胆瘘,胆汁漏至腹腔,引起胆汁性腹膜炎,同时合并包裹性积液,手术探查发现胆汁自肝门工字区漏出,组织脆烂,故选择对合创面,缝合修补并放置腹腔引流管,术后胆瘘量在100~600 mL/d,对症治疗后引流量虽然逐渐减少,但出现了肠梗阻、局部感染、全身感染、梗阻性黄疸以及肝硬度升高,故而再次行肝创面空肠Roux-en-Y吻合术,术后胆瘘治愈,复查未见其他并发症。
以上2例胆瘘位置分别为既往手术创面及肝门工字区,这2例也因胆瘘导致的严重并发症而延误术后化疗。
讨论胆瘘是肝切除术后常见的并发症之一,也是导致术后并发症增加的主要原因[10]。在既往报道中,肝切除术后胆瘘的发病率在3.6% ~26%之间,本研究中胆瘘的发病率为13.3%,与既往报道基本相符[8, 11-14]。
本研究中,7例(58.3%)为PRETEXT Ⅲ期至Ⅳ期,8例(66.7%)肿瘤与第一肝门关系密切,11例(91.7%)肿瘤手术涉及肝中叶切除或部分切除,2例复发患儿在术后均出现胆瘘,复发灶均位于既往手术创面中。PRETEXT分期是依据肿瘤累及肝叶范围定义的,Ⅲ期患儿肿瘤累及两个或3个肝叶,并且没有相邻的两个未受累肝叶;Ⅳ期患儿左外叶、左内叶、右前叶及右后叶均被肿瘤侵犯[9]。所以,Ⅲ期至Ⅳ期患儿手术涉及的肝叶数量往往多于Ⅰ期至Ⅱ期患儿。在解剖上,肝中叶包括左内叶及右前叶,左、右肝管主干穿行于这两个肝叶中,并在这两个肝叶交界处的第一肝门汇合为肝总管,若肿瘤位于肝中叶,手术时损伤胆道主干的风险就会增加。既往文献也提示肝中叶切除、大范围肝脏切除、扩大肝切除和二期肝切除术是胆瘘的危险因素[8, 15, 16]。由此可见手术涉及肝叶越多,手术部位越靠近胆道主干,术后出现胆瘘的可能性越大;对于复发的患儿,即使病灶较小,术中及术后也应警惕胆瘘的发生,因为第一次手术的切缘基本上到达胆道主干,进一步的切割有可能导致更大的风险。
术中胆道造影是判断有无胆道损伤的重要方法[17]。本组5例在术中进行了胆道造影,并未发现造影剂泄露,但术后出现了胆瘘。由此可见,即使术中胆道造影结果为阴性,也不能排除术后出现胆瘘的可能。究其原因,可能是手术创面的延迟性坏死造成了胆道破损[6]。
本研究发现胆瘘出现的中位时间为术后7天,多数(8例)可经检测腹腔引流液胆红素浓度被早期发现,余4例则是以并发症的方式被发现,其中3例为胆汁性的包裹性积液,1例则导致了严重的胆汁性腹膜炎。所以肝母细胞瘤术后应常规监测腹腔引流液胆红素浓度,对于术后存在包裹性积液的患儿,也应定期监测,尽早发现并治疗胆瘘,避免严重并发症的出现。
本研究发现,胆瘘的治疗时间较长,中位时间为3.5个月,但大部分患儿(10例)可通过非手术方法(单纯腹腔外引流或超声引导下穿刺抽液)治愈,这与文献报道一致[17, 18]。目前认为非手术治疗是治疗术后胆瘘的首选方法,并且在成人胆瘘的非手术治疗中,还普遍应用ERCP、ENBD、经皮肝穿胆道引流、经皮肝穿门静脉栓塞术以及CT引导下无水乙醇消融治疗等多种内镜和介入治疗[17, 19-21]。然而,对于年龄较小的胆瘘患儿,上述多种内镜和介入治疗的开展还存在困难[22]。因此,保守治疗无效的情况下还是需要行手术治疗。在手术方法中,可行局部修补或胆道重建术,局部修补虽然创伤小,避免了存在多个吻合口的风险,但长期胆瘘会造成周围组织水肿、炎性增生,甚至感染,从而造成手术修补困难,即使术中成功修补,仍然有很较高风险再次出现胆瘘,本研究中1例尝试了胆道修补术,也未成功。相比之下,胆道重建手术(如胆管空肠Roux-en-Y吻合术或肝创面空肠Roux-en-Y吻合术)更为有效,本研究中2例非手术治疗无效的患儿,均经胆道重建手术治愈,这也与文献报道结果一致[22, 23]。
在文献报道中,胆瘘的位置对治疗方法的选择有明确的指导性,Sakamoto等[6]将与胆树相通的胆瘘定义为中央型胆瘘,将不与胆树相通的胆瘘定义为周围型胆瘘,并发现中央型胆瘘相对较为难治,需行ERCP+支架植入、ENBD或手术治疗,而周围型胆瘘可经外引流或无水乙醇消融治愈。Kimura等[18]也证实了上述分类的有效性。然而,胆瘘位置的确定需经ERCP检查证实,多数肝母细胞瘤患儿年龄较小,较难开展。本研究中,患儿中位发病年龄为2岁,仅2例经手术治疗患儿可明确胆瘘位置,其余10例均无法明确。因此,对于无法明确胆瘘位置的患儿,只能依据其他临床指标(如胆汁引流量和并发症)来选择治疗方法。
胆瘘虽然表面上只是造成消化液的丢失,但持续不愈的胆瘘可继发多种严重并发症,会对患儿造成严重损伤,甚至危及生命。因此,胆瘘的治疗需要避免严重并发症的发生。本研究中仅合并包裹性积液或局部感染的患儿可经非手术方法治愈,而当患儿合并严重并发症时,病情就会逐渐加重,本研究中的2例患儿通过腹腔外引流或胆瘘局部修补治疗,不但没有缓解胆瘘病情,反而继发了各种严重并发症,有1例甚至出现了肝硬度增高的表现,最终都通过胆道重建手术治愈,所以此类患儿如果能尽早行胆道重建手术,造成的损伤可能会大大降低。但是胆道重建手术本身也伴随着风险及二次创伤,因此手术时机的判断和手术指征尤为重要。既往文献对具体的手术指征报道较少,Vigano等[24]研究发现,当患者诊断胆瘘10天后,每日胆瘘量仍>100 mL时,提示保守治疗无效,需行进一步治疗。以上2例患儿经过非手术治疗后,胆瘘量仍持续>100 mL,并且都合并有严重并发症,这一结果与文献报道一致。因此,经非手术治疗后胆瘘量仍持续>100 mL或出现严重并发症时,再次行胆道重建手术可能是更好的处理方式。然而本研究样本较少,若要得出更确切的结论,还需进一步扩大样本量展开分析。
| [1] |
Yang T, Whitlock RS, Vasudevan SA. Surgical management of hepatoblastoma and recent advances[J]. Cancers (Basel), 2019, 11(12): E1944. DOI:10.3390/cancers11121944 |
| [2] |
Brooke-Smith M, Figueras J, Ullah S, et al. Prospective evaluation of the International Study Group for Liver Surgery definition of bile leak after a liver resection and the role of routine operative drainage:an international multicentre study[J]. HPB (Oxford), 2015, 17(1): 46-51. DOI:10.1111/hpb.12322 |
| [3] |
Koch M, Garden OJ, Padbury R, et al. Bile leakage after hepatobiliary and pancreatic surgery:a definition and grading of severity by the International Study Group of Liver Surgery[J]. Surgery, 2011, 149(5): 680-688. DOI:10.1016/j.surg.2010.12.002 |
| [4] |
Zimmitti G, Roses RE, Andreou A, et al. Greater complexity of liver surgery is not associated with an increased incidence of liver-related complications except for bile leak:an experience with 2, 628 consecutive resections[J]. J Gastrointest Surg, 2013, 17(1): 57-64. DOI:10.1007/s11605-012-2000-9 |
| [5] |
Mohkam K, Farges O, Vibert E, et al. Risk score to predict biliary leakage after elective liver resection[J]. Br J Surg, 2018, 105(1): 128-139. DOI:10.1002/bjs.10647 |
| [6] |
Sakamoto K, Tamesa T, Yukio T, et al. Risk factors and managements of bile leakage after hepatectomy[J]. World J Surg, 2016, 40(1): 182-189. DOI:10.1007/s00268-015-3156-8 |
| [7] |
Braunwarth E, Primavesi F, Göbel G, et al. Is bile leakage after hepatic resection associated with impaired long-term survival?[J]. Eur J Surg Oncol, 2019, 45(6): 1077-1083. DOI:10.1016/j.ejso.2019.02.021 |
| [8] |
Spetzler VN, Schepers M, Pinnschmidt HO, et al. The incidence and severity of post-hepatectomy bile leaks is affected by surgical indications, preoperative chemotherapy, and surgical procedures[J]. Hepatobiliary Surg Nutr, 2019, 8(2): 101-110. DOI:10.21037/hbsn.2019.02.06 |
| [9] |
Roebuck DJ, Aronson D, Clapuyt P, et al. 2005 PRETEXT:a revised staging system for primary malignant liver tumours of childhood developed by the SIOPEL group[J]. Pediatr Radiol, 2007, 37(2): 123-132. DOI:10.1007/s00247-006-0361-5 |
| [10] |
Martin AN, Narayanan S, Turrentine FE, et al. Clinical factors and postoperative impact of bile leak after liver resection[J]. J Gastrointest Surg, 2018, 22(4): 661-667. DOI:10.1007/s11605-017-3650-4 |
| [11] |
Maulat C, Regimbeau JM, Buc E, et al. Prevention of biliary fistula after partial hepatectomy by transcystic biliary drainage:randomized clinical trial[J]. Br J Surg, 2020, 107(7): 824-831. DOI:10.1002/bjs.11405 |
| [12] |
Guillaud A, Pery C, Campillo B, et al. Incidence and predictive factors of clinically relevant bile leakage in the modern era of liver resections[J]. HPB (Oxford), 2013, 15(3): 224-229. DOI:10.1111/j.1477-2574.2012.00580.x |
| [13] |
Squires MH 3rd, Lad NL, Fisher SB, et al. Value of primary operative drain placement after major hepatectomy:a multi-institutional analysis of 1, 041 patients[J]. J Am Coll Surg, 2015, 220(4): 396-402. DOI:10.1016/j.jamcollsurg.2014.12.029 |
| [14] |
Nanashima A, Abo T, Shibuya A, et al. Does the placement of a cystic duct tube after a hepatic resection help reduce the incidence of post-operative bile leak?[J]. HPB (Oxford), 2013, 15(7): 517-522. DOI:10.1111/j.1477-2574.2012.00611.x |
| [15] |
Harimoto N, Muranushi R, Hoshino K, et al. Albumin-indocyanine green evaluation (ALICE) grade predicts bile leakage after hepatic resection[J]. Surg Today, 2020, 50(8): 849-854. DOI:10.1007/s00595-020-01955-2 |
| [16] |
Nakano R, Ohira M, Kobayashi T, et al. Independent risk factors that predict bile leakage after hepatectomy for hepatocellular carcinoma:Cohort study[J]. Int J Surg, 2018(57): 1-7. DOI:10.1016/j.ijsu.2018.07.005 |
| [17] |
Kubo N, Shirabe K. Treatment strategy for isolated bile leakage after hepatectomy:Literature review[J]. Ann Gastroenterol Surg, 2020, 4(1): 47-55. DOI:10.1002/ags3.12303 |
| [18] |
Kimura T, Kawai T, Ohuchi Y, et al. Non-surgical management of bile leakage after hepatectomy:a single-center study[J]. Yonago acta medica, 2018, 61(4): 213-219. DOI:10.33160/yam.2018.12.004 |
| [19] |
Murata R, Kamiizumi Y, Ishizuka C, et al. Anterograde bile duct drainage for intractable bile leakage after hepatectomy in a patient with previous pancreatoduodenectomy:A case report[J]. Int J Surg Case Rep, 2019(55): 121-124. DOI:10.1016/j.ijscr.2019.01.017 |
| [20] |
Bressem KK, Erxleben C, Lauscher JC, et al. Successful CT-guided obliteration of isolated bile ducts with ethylene vinyl alcohol copolymer in a patient with chronic bile leakage after hepatectomy[J]. J Vasc Interv Radiol, 2019, 30(10): 1671-1673. DOI:10.1016/j.jvir.2019.05.020 |
| [21] |
Kubo N, Harimoto N, Shibuya K, et al. Successful treatment of isolated bile leakage after hepatectomy combination therapy with percutaneous transhepatic portal embolization and bile duct ablation with ethanol:a case report[J]. Surg Case Rep, 2018, 4(1): 61. DOI:10.1186/s40792-018-0463-y |
| [22] |
Kannappan O, Keditsu K, Bhagat M, et al. Portal vein embolization for future liver remnant enhancement and combined modality treatment for the management of post-hepatic resection biliary fistula in an 18-month old child with hepatoblastoma[J]. Front Surg, 2019(6): 54. DOI:10.3389/fsurg.2019.00054 |
| [23] |
Kada F, Abyad M, Contini S, et al. Fistulojejunostomy for refractory post-traumatic biliary fistula in an austere environment:an unusual, time-honored procedure[J]. J Am Coll Surg, 2015, 220(5): e61-e63. DOI:10.1016/j.jamcollsurg.2015.01.022 |
| [24] |
Viganò L, Ferrero A, Sgotto E, et al. Bile leak after hepatectomy:Predictive factors of spontaneous healing[J]. Am J Surg, 2008, 196(2): 195-200. DOI:10.1016/j.amjsurg.2007.08.062 |
 2020, Vol. 19
2020, Vol. 19


