2. 上海交通大学医学院附属仁济医院泌尿外科(上海市, 200000);
3. 国家人类基因组南方研究中心(上海市, 200000)
2. Department of Urology, Renji Hospital, School of Medicine, Shanghai Jiao Tong University, Shanghai 200000, China;
3. Department of Genetics, Shanghai-MOST Key Laboratory of Health & Disease Genomics, Chinese National Human Genome Center & Shanghai Industrial Technology Institute(SITI), Shanghai 200000, China
性发育异常(disorders of sex development, DSD)是遗传性别、性腺性别或表型性别不一致的一类先天性疾病的总称。2006年芝加哥共识以染色体为标准将DSD分为3种,即性染色体DSD、46, XY DSD和46, XX DSD[1]。46, XY DSD病因和临床表型都具有高度的异质性,给临床上病因诊断带来了巨大的挑战。男性内外生殖器的发育主要涉及以下几个方面:性分化、性发育和雄激素合成及作用等[2, 3]。本研究检索GeneCards等在线数据库及相关文献,选取105个涉及男性性腺分化发育及雄激素合成的基因,构建与尿道下裂相关的目的基因组合(gene panel)。利用Illuminan-Miseqe二代测序平台对110例46, XY DSD患儿致病性基因进行检测,进一步分析其基因型与临床表型,为临床诊断和遗传咨询提供科学依据。
材料与方法 一、临床资料1.研究对象:选取2017—2018年就诊于上海交通大学医学院附属瑞金医院和仁济医院诊断为46, XY DSD患儿110例作为研究对象,包括20例单纯性尿道下裂和90例多种表型DSD。患儿年龄6个月至18岁,平均年龄7.6岁。染色体检查所有患儿为46, XY,SRY基因皆为阳性。10例Ⅰ型尿道下裂(阴茎头和冠状沟型)、40例Ⅱ型尿道下裂(阴茎型)、30例Ⅲ型尿道下裂(阴茎根部和阴茎阴囊型)、30例Ⅳ型尿道下裂(阴囊型和会阴型)。所有检查均获得患儿父母或监护人的知情同意,并通过医院伦理委员会批准([2018]伦审第[157]号)。
2.临床评估:收集患儿的现病史、出生史、个人史、家族史(3代以内直系亲属是否近亲婚配及类似疾病家族史)。检查外生殖器和第二性征发育,有无外生殖器外其他系统畸形。
二、NGS检测方法1.靶向二代测序:①制备全基因组样本文库:用超声波破碎仪将800 ng基因组DNA打断,片段长度150~250 bp;利用KAPA LTP Library Preparation构建DNA样本文库。②RNA探针合成:由iGeneTech公司合成含105个基因编码序列的10 000条oligo库;将oligo序列转录为RNA(通过PCR扩增及转录反应)。③样本DNA与探针RNA杂交:样本DNA文库与RNA探针65℃杂交24 h,目标片段与特异性探针结合后被捕获,再进行PCR扩增。④最终产物经Illumina-Miseq测序平台测序。
2.生物信息学分析:①根据ExAC,1 000Genomes等数据库,将测序结果与人类基因组参考序列比对,进行SNP和InDel注释分析。②利用HGMD (Human Gene Mutation Database)、OMIM (Online Mendelian Inheritance in Men)、Clinvar和Pubmed等数据库分析变异位点。③利用SIFT、PolyPhen2和Mutation Taster等预测软件对变异基因蛋白功能进行预测。④根据美国医学遗传学与基因组学学会(American College of Medical Genetics,ACMG)指南对变异位点进行评估并进行Sanger验证。
结 果 一、临床特征110例46, XY DSD患儿的外生殖器畸形程度不等,其中20例为单纯性尿道下裂,其余90例为多种表型DSD(除尿道下裂以外还伴有小阴茎、隐睾和阴茎阴囊转位等畸形)(见表 1)。
|
|
表 1 110例46, XY DSD患儿临床特征 Table 1 Clinical characteristics of 110 patients with 46, XY DSD |
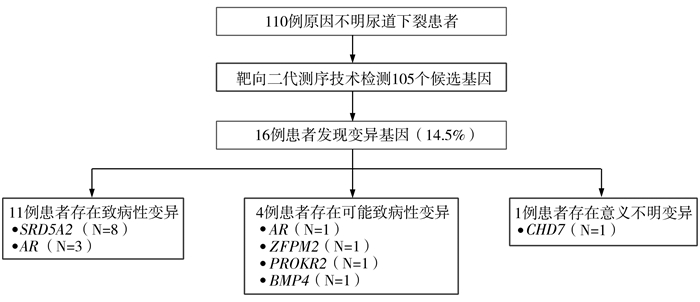
共发现16例患儿存在基因变异,涉及9个基因的13个突变位点,其中包括SRD5A2基因的一个新发突变位点p.P251S。根据ACMG指南评判变异位点,其中15例为诊断性变异(致病性和可能致病性),1例为意义不明确变异。突变主要以复合杂合变异为主,6例存在复合杂合变异,4例为杂合变异,4例为半合子变异,1例为纯合变异,另外1例为双基因变异(表 2)。本研究中最常见的突变基因是SRD5A2 (50%,8/16),其次是AR基因(25%,4/16),其他4个候选基因依次是PROKR2、ZFPM2、BMP4和CHD7 (图 1)。
|
|
表 2 NGS测序基因结果 Table 2 Sequencing results of NGS |
|
Download:
|
| 图 1 15例诊断性变异(致病性和可能致病性)和1例意义不明变异 Fig. 1 15 cases of pathogenic variation (pathogenic & probably pathogenic) and 1 case of variant of uncertain significance | |
16例患儿社会性别均为男性,其中2例有尿道下裂家族史。16例患儿的临床表现:5α还原酶2缺乏症8例,其中尿道下裂8例,小阴茎8例,阴茎弯曲3例(15°~45°),双侧隐睾3例,双侧睾丸钙化1例,鞘膜积液1例,其他畸形2例;雄激素不敏感综合症4例,其中小阴茎4例,阴茎弯曲2例(30°到45°),双侧隐睾2例,阴茎阴囊转位1例,单侧鞘膜积液1例,单侧腹股沟疝1例;其他4例,其中小阴茎2例,单侧隐睾2例,阴茎弯曲1例15°,法洛四联症1例(表 3)。
|
|
表 3 16例基因变异患儿临床资料 Table 3 Clinical data of 16 patients with genetic mutations |
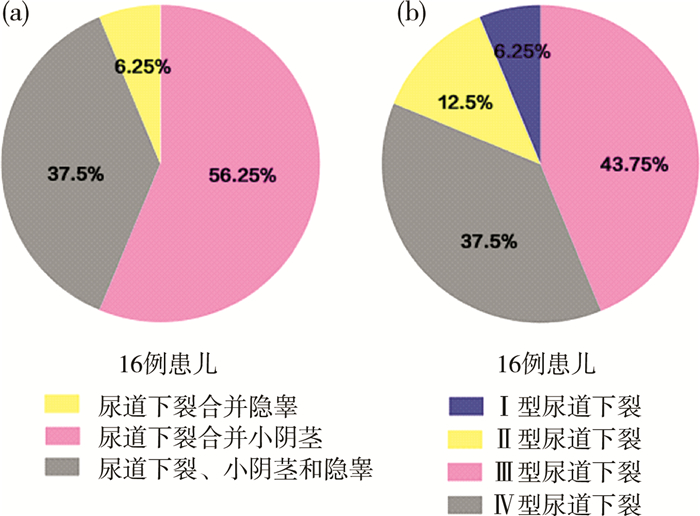
20例单纯性尿道下裂患儿中未发现变异基因,90例多种表型DSD患儿发现16例基因变异。另外,56.25%(9/16)患儿表现为尿道下裂合并小阴茎,37.5%(6/16)患儿表现为尿道下裂、小阴茎和隐睾,6.25%(1/16)患儿表现为尿道下裂合并隐睾(图 2a)。16例患儿尿道下裂严重程度:Ⅰ型1例,Ⅱ型2例,Ⅲ型6例,Ⅳ型7例(图 2b)。由上可见,携带变异基因的患儿最常见临床表型是尿道下裂合并小阴茎,尤其是Ⅲ型和Ⅳ型尿道下裂。
|
Download:
|
| 图 2 16例基因变异患儿外生殖器表现 a:外生殖器表型比例; b:各类型尿道下裂比例 Fig. 2 External genital manifestations in 16 patients with genetic mutations a:Percentages of external genitalia features; b:Percentages of hypospadias types | |
46, XY DSD患儿外生殖器畸形会给患儿及家庭带来沉重的心理压力和经济负担。另外生殖器畸形是局部表现,可能还会伴有内分泌紊乱和存在不育的潜在风险,需要及早明确病因[4]。46, XY DSD遗传背景复杂,临床表型特异性低,病因诊断需要基因检测协助。本研究选取105个与DSD相关的候选基因构建目的基因组合,筛查110例46, XY DSD,共发现16例患儿存在基因变异。
一、SRD5A2基因5α还原酶2缺乏症(5α-reductase type 2 deficiency)是46, XY DSD常见病因,SRD5A2基因变异会造成5α还原酶2活性改变。该酶可将睾酮(testosterone, T)催化成活性更高的雄激素即双氢睾酮(dihydrotestosterone, DHT),促进外生殖器分化发育。5α还原酶2缺乏症的临床表现多样,从小阴茎、隐睾和不同程度尿道下裂等男性化不全表型到完全女性化的表型均存在。青春期会有明显的声音变粗、喉结变大和胡须变多等男性化表型出现。临床上T/DHT比值增高有助于5α还原酶2缺乏症的诊断,但是由于患儿就诊年龄较小,T的数值往往检测不到。因此需要采用HCG激发试验,激发后T/DHT比值往往高于正常值10.5。在本研究中,6例行HCG激发试验的患儿T/DHT比值均明显高于正常值。基因检测共发现8例患儿存在SRD5A2基因变异(占总变异人数的50%)。以往中国人群的研究也显示,SRD5A2基因变异在46, XY DSD比例约为47.22%,与本研究的结果相符[5]。涉及5个变异位点,分别为p.Q6X、p.L20P、p.G203S、p.R227Q、p.P251S,主要分布在第1和第4外显子,可能是SRD5A2基因突变的热点区域。此外,p.R227Q和p.G203S突变频率最高,分别为62.5%(5/8)和37.4%(3/8)。结合以往研究,推测这2个位点可能是变异的热点位点[6]。据报道,p.R227Q、p.G203S、p.L20P和p.Q6X变异都会造成酶活性不同程度的丧失[7, 8]。p.Q6X变异在4例患儿(编号1、2、5、8)中均表现为较严重的男性化不全,推测与基因变异后出现了终止密码子、氨基酸截断后酶功能完全丧失有关。p.P251S为新发变异位点,位于第5外显子,SIFT和PolyPhen预测蛋白的功能有损害。
5α还原酶2缺乏症是指因缺乏DHT造成患儿出现DSD的临床表型。以往临床上给予大剂量睾酮治疗,增加DHT的产生,改善临床症状[9]。但考虑到使用睾酮可能会造成骨龄提前的风险,建议骨龄超过8岁的患儿无需使用睾酮进行治疗。此外,局部使用2.5%双氢睾酮凝胶也可以改善阴茎长度并且避免了骨龄提前[10]。但目前国内尚缺此药。大部分5α还原酶2缺乏症的患儿睾丸功能尚可,建议该类患儿选择性别为男性。另外除因阴茎短小不能手术的患儿建议内分泌治疗以外,大部分患儿不需要治疗。
二、AR基因雄激素不敏感综合征(androgen insensitivity syndrome, AIS)是X染色体隐性遗传病,是AR基因变异后造成雄激素受体功能障碍,靶组织对雄激素产生抵抗所致。本研究在4例患儿中发现4种AR基因变异,分别为p.A871V、p.R608Q、p.A597T及p.Q58L,皆位于重要的结构域[11-13]。AIS根据雄激素受体活性可以分为轻度(MAIS)、部分性(PAIS)和完全性(CAIS)3种类型。本研究中有4例患儿被诊断为PAIS。AIS临床表现具有高度的异质性,是46, XY DSD的常见病因。AIS患者下丘脑-垂体-性腺轴负反馈减弱,垂体分泌的黄体生成素(luteinizing hormone, LH)增多,作用于睾丸Leydig细胞产生T,又因5α还原酶2功能正常,T/DHT比值一般在正常范围内,所以临床可以应用该比值鉴别5α还原酶2缺乏症和AIS。但有些AIS和基因正常患者T/DHT比值也可以增高,本研究中有2例AR基因变异患者比值高于正常值,所以基因检测是鉴别这两类疾病的金标准。
PAIS患儿的AR功能部分障碍,产生雄激素抵抗,一般建议这类患儿分配性别为男性。正常需要肌肉注射超过正常水平5倍剂量的睾酮,才能使功能障碍的AR发挥正常效应,改善阴茎长度。但这类患儿内分泌治疗的效果一般不理想,并且尿道下裂手术更易出现并发症[14]。
三、其他46, XY DSD相关基因1.PROKR2(prokineticin receptor 2 gene):该基因是G蛋白7次跨膜区受体家族成员。该基因变异可以影响胚胎期GnRH神经元前体从嗅前区中枢神经迁移到下丘脑,导致垂体产生的促性腺激素减少,造成低促性腺激素性性腺功能减退症(hypogonadotropic hypogonadism, HH)。本研究发现2例患儿存在PROKR2基因杂合变异,位点为p.W178S,位于第4个跨膜结构域。据报道,p.W178S突变后不仅损害了受体细胞表面的靶向性,而且也影响了下游Gq蛋白的激活[15]。编号第7、14的患儿携带PROKR2基因相同突变位点,但前者的临床表型较严重,推测可能是因为P7还合并SRD5A2基因变异。以往认为HH患儿不会出现尿道下裂,但近年来多项研究在HH患儿中发现尿道下裂,具体机制尚未清楚,需要进一步的功能研究[16, 17]。
2.ZFPM2:该基因编码含1 151个氨基酸的转录辅助因子,其中包括8个锌指结构域。有研究发现ZFPM2在心脏、脑和性腺中与GATA4共表达。GATA4已经被证明与ZFPM2和SF-1调节性别决定或分化的其他关键基因的表达,如SOX9和AMH[18]。本研究在编号13的患儿中发现1个ZFPM2基因杂合变异p.M703L,该突变位点曾在先天性心脏病患儿中报道过[19]。ZFPM2基因的第1和第6锌指结构与GATA4蛋白的N末端锌指内的保守序列相互作用,p.M703L恰巧在第6锌指结构,可能造成ZFPM2与GATA4结合障碍,使GATA4-ZFPM2复合物启动性腺发育通路受到破坏[20]。编号13患儿除表现为Ⅳ型尿道下裂和小阴茎外,还合并法洛四联症。患儿母亲也携带该突变位点,但没有心脏和外生殖器的畸形,造成患儿及母亲表型不一致的原因尚不清楚,可能需要进一步的功能研究。
3.BMP4:该基因位于第14号染色体,属于TGF-β超家族成员。尿道在胚胎的发育涉及TGF-β和Hedgehog 2个信号通路,BMP4是这2个信号通路下游的主要效应分子。本研究在编号15的患儿中发现BMP4基因杂合变异p.H251Y,同时存在Ⅱ型尿道下裂合并小阴茎。该位点位于BMP4蛋白的前导肽区域,可能会影响到整个蛋白的成熟及功能。以往研究在中国尿道下裂患儿中也发现过该位点变异[21, 22]。根据ACMG指南判断为可能致病性变异。
4.CHD7:该基因位于第8号染色体,胚胎期在组织器官中广泛表达,主要参与染色质重塑、胚胎干细胞多能性调节、细胞周期和凋亡调节等[23]。目前认为CHD7基因与CHARGE综合征和Kallmann综合征相关[24]。本研究在编号16的患儿中发现CHD7基因的杂合变异p.T730I,同时有Ⅱ型尿道下裂和右侧隐睾。p.T730I位于SANT结构域中,该结构域高度保守,结构改变后可能会造成修饰的组蛋白或DNA与组蛋白尾结合障碍。但目前根据ACGM指南评判为意义不明变异,仍需做进一步的功能研究。
四、小结本研究共发现16例患儿存在基因变异,其中15例为致病性变异。基因变异患儿临床主要表现为尿道下裂合并小阴茎和(或)隐睾,临床上需要格外注意这类患儿是否存在基因变异。另外本研究中20例单纯性尿道下裂患儿未发现基因变异或基因变异率低,但也可能与本研究样本量少有关,需要进一步扩大样本量。本研究结果显示46, XY DSD最常见的变异基因是SRD5A2和AR,另4个候选基因检出率虽不高,亦不能忽视。46, XY DSD病因和临床表型都具有高度异质性,给临床病因诊断造成一定的困难。利用高通量的基因检测,可以早期确诊部分46, XY DSD患儿病因,制定合理的治疗方案并提供遗传咨询。
| 1 |
Hughes IA, Houk C, Ahmed SF, et al. Consensus statement on management of intersex disorders[J]. Arch Dis Child, 2006, 2(3): 148-162. DOI:10.1136/adc.2006.098319. |
| 2 |
Bouty A, Ayers KL, Pask A, et al. The genetic and environmental factors underlying hypospadias[J]. Sexual Development, 2015, 9(5): 239-259. DOI:10.1159/000441988. |
| 3 |
Kalfa N, Gaspari L, Ollivier M, et al. Molecular genetics of hypospadias and cryptorchidism recent developments[J]. Clin Genet, 2019, 95(1): 122-131. DOI:10.1111/cge.13432. |
| 4 |
Allen TD, Griffin JE. Endocrine studies in patients with advanced hypospadias[J]. J Urol, 1984, 131(2): 310-314. DOI:10.1016/s0022-5347(17)50360-2. |
| 5 |
吴鼎文, 吴德华, 郑静, 等. 46, XY性发育异常与单基因变异的相关性研究[J]. 临床小儿外科杂志, 2019, 18(3): 191-195. DOI:10.3969/j.issn.1671-6353.2019.03.006. Wu DW, Wu DH, Zheng J, et al. Correlations between phenotype and monogenic mutation of 46, XY sexual development disorder[J]. J Clin Ped Sur, 2019, 18(3): 191-195. DOI:10.3969/j.issn.1671-6353.2019.03.006. |
| 6 |
Yuan S, Meng L, Zhang Y, et al. Genotype-phenotype correlation and identification of two novel SRD5A2 mutations in 33 Chinese patients with hypospadias[J]. Steroids, 2017, 125: 61-66. DOI:10.1016/j.steroids.2017.06.010. |
| 7 |
Makridakis NM, di Salle E, Reichardt JK. Biochemical and pharmacogenetic dissection of human steroid 5 alpha-reductase type Ⅱ[J]. Pharmacogenetics, 2000, 10(5): 407-13. DOI:10.1097/00008571-200007000-00004. |
| 8 |
Ittiwut C, Pratuangdejkul J, Supornsilchai V, et al. Novel mutations of the SRD5A2 and AR genes in Thai patients with 46, XY disorders of sex development[J]. J Pediatr Endocrinol Metab, 2017, 30(1): 19-26. DOI:10.1515/jpem-2016-0048. |
| 9 |
Costa EM, Domenice S, Sircili MH, et al. DSD due to 5α-reductase 2 deficiency-from diagnosis to long term outcome[J]. Semin Reprod Med, 2012, 30(5): 427-431. DOI:10.1055/s-0032-1324727. |
| 10 |
Vupputuri M, Kandepu M, Devireddy HR. 5 alpha-reductase type 2 deficiency:response to dihydrotestosterone gel[J]. Indian J Pediatr, 2014, 81(8): 821-823. DOI:10.1007/s12098-013-1032-9. |
| 11 |
Fu XH, Zhang WQ, Qu XS. Correlation of androgen receptor and SRD5A2 gene mutations with pediatric hypospadias in 46, XY DSD children[J]. Genet Mol Res, 2016, 15(1): 15018232. DOI:10.4238/gmr.15018232. |
| 12 |
Yuan SM, Zhang YN, Du J, et al. Phenotypic and molecular characteristics of androgen insensitivity syndrome patients[J]. Asian J Androl, 2018, 20(5): 473-478. DOI:10.4103/aja.aja_17_18. |
| 13 |
Ollivier M, Paris F, Philibert P, et al. Family history is underestimated in children with isolated hypospadias:a French multicenter report of 88 families[J]. J Urol, 2018, 200(4): 890-894. DOI:10.1016/j.juro.2018.04.072. |
| 14 |
唐达星. 46, XY性别发育基本过程相关异常的发生及处理建议[J]. 临床小儿外科杂志, 2019, 18(3): 1671-6353. DOI:10.3969/j.issn.1671-6353.2019.03.001. Tang DX. Occurrence of initial process of 46, XY sex abnormal development and the corresponding management recommendations[J]. J Clin Ped Sur, 2019, 18(3): 1671-6353. DOI:10.3969/j.issn.1671-6353.2019.03.001. |
| 15 |
Monnier C, Dodé C, Fabre L, et al. PROKR2 missense mutations associated with Kallmann syndrome impair receptor signalling activity[J]. Hum Mol Genet, 2009, 18(1): 75-81. DOI:10.1093/hmg/ddn318. |
| 16 |
Wang Y, Gong C, Qin M, et al. Clinical and genetic features of 64 young male paediatric patients with congenital hypogonadotropic hypogonadism[J]. Clin Endocrinol (Oxf), 2017, 87(6): 757-766. DOI:10.1111/cen.13451. |
| 17 |
Ayers KL, Bouty A, Robevska G, et al. Variants in congenital hypogonadotrophic hypogonadism genes identified in an Indonesian cohort of 46, XY under-virilised boys[J]. Hum Genomics, 2017, 11(1): 1. DOI:10.1186/s40246-017-0098-2. |
| 18 |
Bashamboo A, Brauner R, Bignon-Topalovic J, et al. Mutations in the FOG2/ZFPM2 gene are associated with anomalies of human testis determination[J]. Hum Mol Genet, 2014, 23(14): 3657-3665. DOI:10.1093/hmg/ddu074. |
| 19 |
Zhang W, Shen L, Deng Z, et al. Novel missense variants of ZFPM2/FOG2 identified in conotruncal heart defect patients do not impair interaction with GATA4[J]. PLoS One, 2014, 9(7): e102379. DOI:10.1371/journal.pone.0102379. |
| 20 |
Brennan J, Capel B. One tissue, two fates:molecular genetic events that underlie testis versus ovary development[J]. Nat Rev Genet, 2004, 5(7): 509-521. DOI:10.1038/nrg1381. |
| 21 |
Chen T, Li Q, Xu J, et al. Mutation screening of BMP4, BMP7, HOXA4 and HOXB6 genes in Chinese patients with hypospadias[J]. Eur J Hum Genet, 2007, 15(1): 23-28. DOI:10.1038/sj.ejhg.5201722. |
| 22 |
Brauner R, Picard-Dieval F, Lottmann H, et al. Familial forms of disorders of sex development May be common if infertility is considered a comorbidity[J]. BMC Pediatr, 2016, 16(1): 195. DOI:10.1186/s12887-016-0737-0. |
| 23 |
Balasubramanian R, Crowley J. Reproductive endocrine phenotypes relating to CHD7 mutations in humans[J]. Am J Med Genet C Semin Med Genet, 2017, 175(4, SI): 507-515. DOI:10.1002/ajmg.c.31585. |
| 24 |
Blake KD, Prasad C. CHARGE syndrome[J]. Orphanet J Rare Dis, 2006, 1: 34. DOI:10.1186/1750-1172-1-34. |
 2019, Vol. 18
2019, Vol. 18


