2. 深圳市儿童医院 普外二科(广东省深圳市, 518000)
2. Shenzhen Children's Hospital, Shenzhen 518000, China
胆道闭锁(biliary atresia,BA)主要是由肝内、肝外胆管进行性纤维化及炎症所致,致死率较高。目前BA病因尚未得到确证,相关病因学研究主要围绕先天性发育不良、胆汁酸代谢异常、病毒感染、免疫功能异常、胰胆管连接畸形、基因突变及环境因素作用等方面展开[1-3]。随着近年来生物信息学及分子机制研究的迅速发展,BA的基因学研究开始逐渐受到国内外学者的关注。有学者曾发现GPC1基因参与了BA的发生、发展过程,但该基因在BA患儿肝脏中的具体表达情况尚不明确[4]。为进一步探讨GPC1 mRNA及其蛋白产物对BA患儿的诊断价值,本研究将以深圳市儿童医院2016年7月至2018年2月收治的35例BA患儿为研究对象,对其肝脏组织中GPC1的分布、表达及其临床意义进行研究。
材料与方法 一、临床资料(一)观察组:选取2016年7月至2018年2月深圳市儿童医院收治并确诊的BA患儿35例,其中女21例,男14例,年龄0~3个月,平均日龄(33±5)d。BA诊断标准:①有黄疸表现者;②术前肝功能提示以直接胆红素升高为主者;③B超检查怀疑胆道闭锁者;④术中碘普罗胺胆道造影检查确诊为BA者。分型采用国际通用标准分为3型(Ⅰ型、Ⅱ型、Ⅲ型)。入组标准:术前诊断为胆道系统疾病,并于术中及术后通过病理检查证实为BA者。排除标准:同期患有其它BA相关疾病(如肝硬化伴门脉高压、脾脏畸形、肝内结石、消化道出血、内分泌系统疾病)者。
(二)对照组:由于伦理层面的限制,本研究无法获取人类正常肝脏组织作为对照组。因此我们在参考大量国内外文献的基础上借鉴其对照组的选择方式选取了胆红素、肝酶等肝功能指标均正常的先天性胆总管扩张症(choledochal cyst,CC)患儿作为本研究中BA组的对照组。选取同期在深圳市儿童医院接受治疗的CC患儿42例,其中女25例,男17例,年龄0~3岁,平均年龄为(270±9)d,基线资料与观察组均无统计学差异(P>0.05)。CC诊断标准:①术前超声提示胆总管扩张者;②MRCP见胆总管直径>5 mm者;③术中确诊为胆总管扩张者。入组标准:①经手术及病理诊断为CC者;②肝功能(总胆红素、直接胆红素、谷丙转氨酶、谷草转氨酶、谷氨酰转肽酶等)正常者。排除合并肝硬化伴门脉高压、肝内结石、肾脏、消化道出血、肾脏、内分泌等其他系统疾病者。
本研究获深圳市儿童医院伦理道德委员会批准,正式开展前已征得所有入选患儿家长的同意。
二、实验方法(一)实验试剂:RNA提取试剂盒(Takara);逆转录与荧光定量试剂盒(Takara);引物(Invitrogen);GPC1鼠源性单克隆抗体(Santa Cruz,sc-101827);β-actin鼠源性单克隆抗体(Cell Signaling Technology,#3700);Anti-mouse IgG,HRP-linked antibody (CST,#7076);转膜缓冲液由2.9 g甘氨酸、5.8 g Tris、0.37 g SDS、200 mL甲醇、ddH2O 800 mL(加至1 000 mL)混合而成;pH7.4、0.01 mol的PBS由KCl 0.2 g、NaCl 8.0 g、Na2HPO4 1.44 g、KH2PO4 0.24 g、ddH2O加至1 000 mL混合而成;膜染色液成分:0.2 g考马斯亮兰;乙酸2 mL、80 mL甲醇、ddH2O 118 mL;显色液成分:0.01 mol PBS 10.0 mL、DAB 6.0 mg、硫酸镍胺0.1 mL、H2O2 1.0 μL混合而成。其它试剂:福尔马林、无水乙醇、柠檬酸钠抗原修复液、二甲苯液等。
(二)特异性引物序列:采用Primer Premier 6.1软件设计引物序列。GPC1引物序列正向引物:5′-AGCGACGTGGTCCGGAAAGT-3′,反向引物:5′-CATGGAGTCCAGGAGGTTCCTCC-3′;GADPH内参引物序列正向引物:5′-ATGGGTGTGAACCATGAGAAGTATG-3′,反向引物:5′-GGTGCA GGAGGCATTGC-T-3′。
(三)实验标本处理:术中获取肝脏活检标本预处理至绿豆大小,并立即分装于含义RNALater保护液的EP管中,置于4℃冰箱内过夜,次日将标本转至-80℃冰箱内保存。
(四)主要实验过程:采用免疫组化(immunohistochemistry)法检测GPC1在BA患儿肝组织中的表达:①实验组35例标本中,每例取一部分于福尔马林液中浸泡12 h,予以不同浓度的乙醇脱水,脱水后石蜡包埋,最后切片至每层5~8 μm,放置于载玻片上,于45℃恒温烤箱中烘干。②石蜡切片经过二甲苯脱蜡,依次经无水乙醇、95%乙醇、80%乙醇、70%乙醇和水进行水化,最后蒸馏水水洗。③抗原修复:将1 500~3 000 mL的枸橼酸盐缓冲液注入不锈钢压力锅中加热至沸腾。切片置于金属架上,放入锅内,使切片位于液面以下,盖锅压阀。当压力锅开始慢慢喷气时(加热5~6 min),计时1~2 min,将压力锅端离热源,冷水冲至室温后取出切片,蒸馏水洗后,PBS冲洗3次,每次2 min。④一抗孵育1 : 1 000稀释的GPC1单克隆抗体200 μL,37℃孵育1 h;PBS冲洗3次,每次5 min。⑤二抗孵育1 : 10 000稀释二抗200 μL,37℃孵育45 min;PBS冲洗3次,每次5 min。⑥显色液显色,显微镜下观察显色程度,自来水冲洗,终止反应。⑦Harris苏木素液复染细胞核1 min,依次经95%乙醇、100%乙醇脱水,二甲苯透明,中性树胶封片。⑧镜下观察褐色沉着即为GPC1表达阳性。
采用蛋白印记法(Western blot)检测肝脏中GPC1蛋白的表达:采用液氮法对蛋白进行提取,在-80℃的环境中进行保存、待检。将蛋白样品进行稀释和定量,取20 μL通过电泳测定蛋白质的表达水平。蛋白表达水平的测定采用免疫印迹技术,对肝组织中的GPC1蛋白表达进行测定,稀释并定量组织中的蛋白样品,取20 μL进行电泳,PVDF转膜、脱脂,加入抗体,采用显色剂进行显影、定影,采用凝胶成像系统对条带灰度值进行扫描,同时计算蛋白质的表达水平。
采用实时荧光定量核酸扩增检测系统(qPCR)检测肝脏标本中GPC1-mRNA的表达。1.对肝脏组织中的总RNA进行提取。①组织裂解:取葛西手术中留取的肝脏组织标本5 mg,充分研磨后转移至EP管中,并加入600 μL Buffer RL裂解液(使用前已加入50×DTT solution),用1 000 μL规格移液枪反复吹打裂解液,直至未见明显沉淀;②离心:将裂解液离心5 min(12 000 rpm、4℃);③转移、去除杂质及gDNA:离心后裂解液的上层清液转移至放置在2 mL收集管的中的gDNA Eraser Spin Column内,并离心1 min(12 000 rpm、24℃);④稀释RNA:向过滤液中加入等体积的75%乙醇,并使用移液枪反复吹打;⑤结合RNA、清洗RNA Spin;⑥洗脱RNA:往放置在RNase Free Collection中的RNA spin Column中加入50 μL RNase Free dH2O,静置10 min后离心4 min(12 000 rpm、24℃);⑦储存总RNA:将总RNA置于-80℃冰箱中储存。2. mRNA逆转录:①去除基因组DNA反应:按说明书在冰上配置Master Mix,然后分装到八排管内,加入已提取的总RNA样品,24℃静置30 min;②逆转录反应:按说明书在冰上配置Master Mix,然后分装至装有反应液的八排管内,均匀混合后按照反应条件要求进行逆转录反应。3.实时荧光定量PCR(qPCR)检测GPC1的表达:①配置PCR反应液:冰上预先配置总混合液,然后分装到八排管内,每管18 μL,最后将cDNA液加至每个小管内,液体配置全程在冰上进行操作;②均匀混合,避免加样的过程中产生气泡,如产生气泡可离心将其去除,避免其干扰PCR仪对荧光信号的读取;③扩增目的基因:将八排管放置在qPCR仪上,按条件进行qPCR反应;④qPCR扩增产物的特异性检测:根据溶解曲线对扩增产物进行分析,若溶解曲线分析见目的基因GPC1及内参基因GADPH均仅呈现单一溶解峰,且所有波峰高尖,无非特异性的多株峰或荧光信号(即多个溶解峰),则提示扩增产物特异性良好。
三、观察指标通过免疫组化结果了解GPC1在胆道闭锁肝脏中的分布;通过qPCR及Western blot对胆道闭锁(BA)及先天性胆总管扩张症(CC)患儿肝脏中的GPC1蛋白水平、GPC1 mRNA水平进行检测。
四、统计学处理采用GraphPad Prism 7.00进行统计分析,本次研究所涉及的数据资料均为计量资料,服从正态分布的计量资料用(x±s)表示,两组间的计量资料比较采用独立样本t检验。P<0.05为差异具有统计学意义。
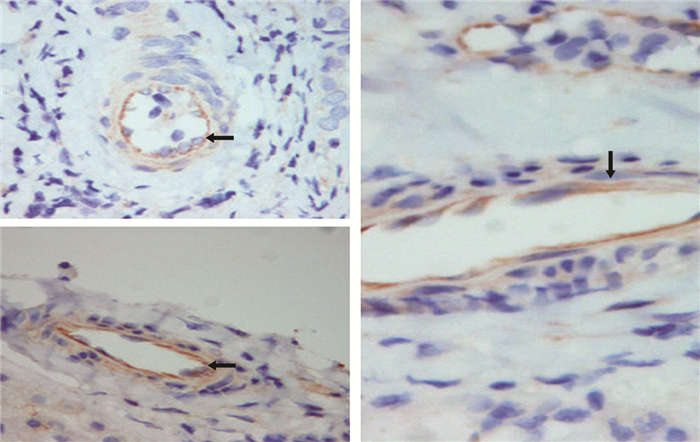
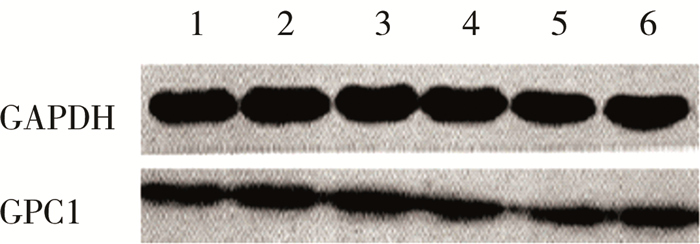
结 果GPC1在BA患儿中主要分布在胆管细胞顶部(图 1)。BA组与CC组患儿肝脏标本中GPC1蛋白含量存在差异,且具有统计学意义(P < 0.05)。详见表 1、图 2。
|
Download:
|
| 图 1 GPC1在胆道闭锁肝脏组织中的分布(DBA染色,×400)。褐色为GPC1阳性表达区(箭头处),提示GPC1位于胆管上皮细胞顶部。 Fig. 1 GPC1 expression of BA in liver tissue (DBA staining×400).DBA staining.Brown areas were GPC1 positive (arrows), indicating GPC1 was located at the top of cholangiocytes | |
|
|
表 1 两组GPC1蛋白量表达量比较(x±s) Table 1 Comparison of protein expression levels of GPC1 in two groups(x±s) |
|
Download:
|
| 图 2 Western Blot测量BA与CC患儿肝组织GPC1蛋白表达水平,GAPDH为内参蛋白,1、2、3为CC组,4、5、6为BA组。图中可见CC组与BA组内参蛋白GADPH浓度基本一致,而CC组GPC1蛋白表达水平略高于BA组 Fig. 2 Western blot was used for measuring the expression profile of GPC1 at protein level in BA and CC livers.Numbers 1, 2 and 3 was CC group while numbers 4, 5 and 6 referred to BA group.GADPH, an internal reference protein, was expressed similarly in all groups.The expression of GPC1 at protein levels was higher in CC group than BA group | |
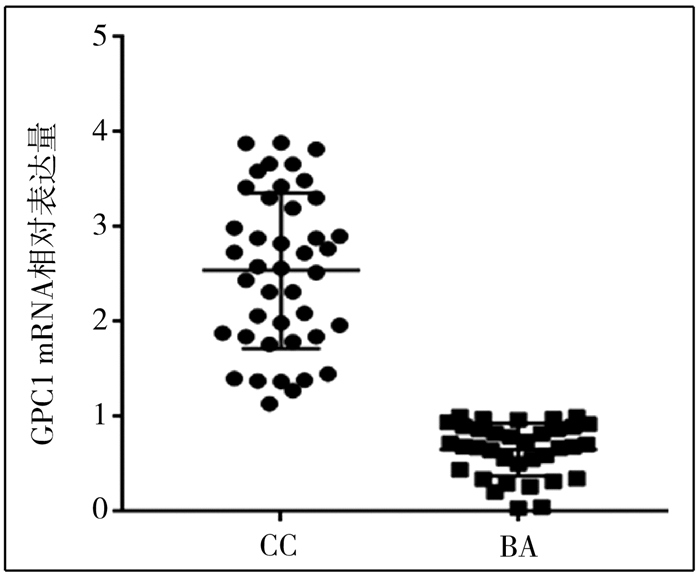
GPC1 mRNA在CC组中呈高表达,而在BA组的表达相对呈低水平,差异有统计学意义(2.54±0.12 vs. 0.65±0.05,P < 0.05)。详见图 3。
|
Download:
|
| 图 3 观察组与对照组肝组织中GPC1 mRNA水平比较 Fig. 3 Comparison of GPC1 mRNA levels between BA and CC groups | |
BA是小儿接受肝移植的主要原因,早期诊断、手术解除胆道梗阻是治疗成功的关键[5]。近年来,BA相关的全基因组关联研究(genome-wide association study,GWAS)报道了许多BA易感基因,包括CFC1 [6]、ICAM1[7]、MIF[8]、ADD3[9]等。GPC1最先由Melissa等[10]发现,该研究者对35例BA患儿进行了超过5.5×105个单核苷酸多态性样本的GWAS研究,发现在2q37.3上存在一个杂合性缺失,且不同的BA患儿均存在此缺失,因此高度怀疑该区域存在BA的易感基因。为证实这一结论,Cui等[11]增加了GWAS研究的例数(包括BA患儿61例及正常个体5 088例),发现相关CNV区域只存在一个基因—GPC1,并在斑马鱼中设计了针对GPC1的核苷酸序列(MOs),确定了GPC1基因与BA发病相关。本课题组的前期研究结果也发现GPC1的常见变异可影响BA的发生[12]。为进一步探讨GPC1在BA中的具体表达情况,本研究首先对观察组的35例胆道闭锁肝脏标本进行免疫组化分析,结果发现GPC1蛋白主要附着在肝内胆管的胆管细胞顶部,与以往的研究结果相符[11]。
GPC1是位于2号染色体长臂3区7带的一个基因,其mRNA编码的GPC1蛋白是硫酸肝素蛋白多糖家族(GPCs)的6个成员之一, 通过糖苷-磷脂酰肌醇键与细胞膜相连[13]。研究表明GPC1蛋白是肝素结合生长因子(HBGFs)受体的一种,肝素结合生长因子常在人类肿瘤中表达(如:胰腺癌、乳腺癌及人神经胶质细胞瘤等),主要通过调控Hedgehog、Wnt及细胞膜表面生长因子配体与受体的结合,促进信号传导,调节细胞生物活性,增强细胞的分裂、迁徙等过程,同时也可参与肿瘤的发生、转移及血管的生成[14-16]。此外,GPC1蛋白也被认为是成纤维母细胞(fibroblast growth factor, FGF)的共受体,可促进FGF与其受体(FGFR)的结合,进而促进FGF-FGFR的激活和信号传导,参与成纤维细胞及上皮细胞生成[17]。Aránzazu等[18]也发现血管内皮细胞(ECs)中低水平的FGFR1会使血管生成反应受损,而GPC1负责将细胞表面FGF2维持在足以激活FGFR1的水平,以确保靶基因的激活,促进血管生成。因此,有理由认为位于胆管上皮细胞顶部的GPC1蛋白主要通过以上途径影响肝脏组织中血管、胆管的生成及纤维化,从而参与BA的发生。
本研究发现BA组肝组织中GPC1-mRNA、GPC1蛋白的表达水平均低于CC组,表明BA的发生发展可能与肝胆组织细胞中GPC1的低表达密切相关。从GPC1的分子生物学功能来看,我们猜测低表达水平的GPC1可能会影响HBGFs、FGFR的表达,从而抑制胆管上皮细胞的增生和血管的生成;同时低水平的GPC1可能抑制成纤维细胞生成,从而诱发BA。
本研究的主要局限性在于对照组的设置。因我院目前尚未实施尸检,也难以获得流产、弃婴个体等对比意义更加明确的个体充当本研究对照。因此我们在参考大量国内外文献的基础上,选取了目前认可度相对较高的先天性胆总管扩张症患儿(其对照意义主要在于其肝功能正常)作为对照。但因胆总管扩张症患儿就诊年龄普遍大于BA患儿,因此不能完全排除年龄对GPC1蛋白表达的影响。总之,GPC1可能与胆道闭锁的发病密切相关,但GPC1参与胆道闭锁发病的具体机制仍有待进一步阐明。
| 1 |
Asai A, Miethke A, Bezerra JA. Pathogenesis of biliary atresia:defining biology to understand clinical phenotypes[J]. Nat Rev Gastroenterol Hepatol, 2015, 12(6): 342-345. DOI:10.1038/nrgastro.2015.74. |
| 2 |
Wen J, Xiao Y, Wang J, et al. Low doses of CMV induce autoimmune-mediated and inflammatory responses in bile duct epithelia of regulatory T cell-depleted neonatal mice[J]. Lab Invest, 2015, 95(2): 180-192. DOI:10.1038/labinvest.2014.148. |
| 3 |
郭振亚, 张若岩, 柳明江, 等. 先天性胆道闭锁的病因研究进展[J]. 临床肝胆病杂志, 2015, 31(8): 1343-1346. DOI:10.3969/j.issn.1001-5256.2015.08.043. Guo ZY, Zhang RY, Liu MG, et al. Etiology of congenital biliary atresia[J]. Journal of Clinical Hepatobiliary Diseases, 2015, 31(8): 1343-1346. DOI:10.3969/j.issn.1001-5256.2015.08.043. |
| 4 |
Tang V, Cofer ZC, Cui S, et al. Loss of a candidate biliary atresia susceptibility gene, add3a, causes biliary developmental defects in zebrafish[J]. J Pediatr Gastroenterol Nutr, 2016, 63(5): 524-530. DOI:10.1097/MPG.0000000000001375. |
| 5 |
李智涵, 王斌. Ⅲ型胆道闭锁手术治疗的研究进展[J]. 临床小儿外科杂志, 2016, 15(1): 11-13. DOI:10.3969/j.issn.1671-6353.2016.01.004. Li ZH, Wang B. Advances in surgical treatment of biliary atresia of type Ⅲ[J]. J Clin Ped Sur, 2016, 15(1): 11-13. DOI:10.3969/j.issn.1671-6353.2016.01.004. |
| 6 |
Asai A, Miethke A, Bezerra JA. Pathogenesis of biliary atresia:defining biology to understand clinical phenotypes[J]. Nat Rev Gastroenterol Hepatol, 2015, 12(6): 342-352. DOI:10.1038/nrgastro.2015.74. |
| 7 |
Hill JJ, Tremblay TL, Fauteux F, et al. Glycoproteomic comparison of clinical triple-negative and luminal breast tumors[J]. Journal of Proteome Research, 2015, 14(3): 1376-1388. DOI:10.1021/pr500987r. |
| 8 |
Sadek KH, Ezzat S, Abdel-Aziz SA, et al. Macrophage migration inhibitory factor (MIF) gene promotor polymorphism is associated with increased fibrosis in biliary atresia patients, but not with disease susceptibility[J]. Ann Hum Genet, 2017, 81(5): 177-183. DOI:10.1111/ahg.12199. |
| 9 |
Tang V, Cofer ZC, Cui S, et al. Loss of a candidate biliary atresia susceptibility gene, add3a, causes biliary developmental defects in zebrafish[J]. J Pediatr Gastroenterol Nutr, 2016, 63(5): 524-530. DOI:10.1097/MPG.0000000000001375. |
| 10 |
Leyva-Vega M, Gerfen J, Thiel BD, et al. Genomic alterations in biliary atresia suggest region of potential disease susceptibility in 2q37.3[J]. Am J.Med.Genet.A, 2010, 152A(4): 886-895. DOI:10.1002/ajmg.a.33332. |
| 11 |
Cui S, Leyva-Vega M, Tsai EA, et al. Evidence from human and zebrafish that GPC1 is a biliary atresia susceptibility gene[J]. Gastroenterology, 2013, 144(5): 1107-1115. DOI:10.1053/j.gastro.2013.01.022. |
| 12 |
Ke J, Zeng S, Mao J, et al. Common genetic variants of GPC1 gene reduce risk of biliary atresia in a Chinese population[J]. J Pediatr.Surg, 2016, 51(10): 1661-1664. DOI:10.1016/j.jpedsurg.2016.05.009. |
| 13 |
Melo SA, Luecke LB, Kahlert C, et al. Glypican-1 identifies cancer exosomes and detects early pancreatic cancer[J]. Nature, 2015, 523(7559): 177-182. DOI:10.1038/nature14581. |
| 14 |
Lu H, Niu F, Liu F, et al. Elevated glypican-1 expression is associated with an unfavorable prognosis in pancreatic ductal adenocarcinoma[J]. Cancer Med, 2017, 6(6): 1181-1191. DOI:10.1002/cam4.1064. |
| 15 |
Hara H, Takahashi T, Serada S, et al. Overexpression of glypican-1 implicates poor prognosis and their chemoresistance in oesophageal squamous cell carcinoma[J]. Br J Cancer, 2016, 115(1): 66-75. DOI:10.1038/bjc.2016.183. |
| 16 |
Lai X, Wang M, McElyea SD, et al. A microRNA signature in circulating exosomes is superior to exosomal glypican-1 levels for diagnosing pancreatic cancer[J]. Cancer letters, 2017, 393(1): 86-93. DOI:10.1016/j.canlet.2017.02.019. |
| 17 |
Li J, Li B, Ren C, et al. The clinical significance of circulating GPC1 positive exosomes and its regulative miRNAs in colon cancer patients[J]. Oncotarget, 2017, 8(60): 101189-101202. DOI:10.18632/oncotarget.20516. |
| 18 |
Chamorro-Jorganes A, Araldi E, Rotllan N, et al. Autoregulation of glypican-1 by intronic microRNA-149 fine tunes the angiogenic response to FGF2 in humanendothelial cells[J]. J Cell Sci, 2014, 127(6): 1169-1178. DOI:10.1242/jcs.130518. |
 2019, Vol. 18
2019, Vol. 18


