肝母细胞瘤是儿童最常见的肝脏恶性肿瘤。由于发病隐匿,约50%的患儿就诊时已错过最佳治疗时机,此时肿瘤很难通过手术完整切除[1]。国际儿童肝脏肿瘤研究协会(Société Internationale d'Oncologie Pédiatrique-Epithelial Liver Tumor Study Group, SIOPEL)认为,对此类肝母细胞瘤患儿应给予术前化疗以达到使肿瘤体积缩小的目的,肿瘤体积缩小后再行手术治疗[2-4]。但化疗前需明确病理诊断和分型以确定治疗方案。据报道,超声引导下粗针穿刺活检技术因具有简单、安全、高效等特性而被广泛应用于成人乳腺肿瘤、前列腺肿瘤的活检[5-6]。但在儿童肿瘤领域,国内针对其准确性、安全性的报道相对较少[7-8]。因此本研究将初步探讨超声引导粗针穿刺诊断儿童肝母细胞瘤的准确性和安全性。
材料与方法 一、临床资料2013年6月至2014年12月上海交通大学医学院附属新华医院小儿外科共收治行穿刺活检的肝脏肿瘤患儿38例,其中男23例,女15例,年龄1个月至12岁,平均年龄(24.11±26.09)个月。手术可切除性评估标准参照中国抗癌协会儿童肝母细胞瘤多学科诊疗专家共识:①ASA评分1~2级;②Pretext分期为Ⅰ、Ⅱ期单发肿瘤病灶,未累及重要血管;③残存肝脏组织能够满足代谢需要。以上3条标准中任意一条不符合者即考虑行穿刺活检。38例血AFP均高于正常值,血常规、凝血功能、肝肾功能均正常。术前CT增强结果提示疑似肝母细胞瘤35例,疑似肝血管内皮瘤2例,疑似肝脏局灶性结节增生(focal nodular hyperplasia, FNH)1例。
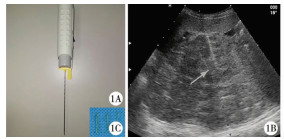
二、研究方法所有穿刺活检操作均于全身麻醉下进行。超声引导穿刺定位使用Hitachi 7500型彩色多普勒超声诊断仪,配备腹部凸阵探头C7-1-5,频率1~5 MHz;穿刺探头EUPB314,频率3.5 MHz。穿刺活检枪使用美国BARD 18G一次性自动活检枪,内径1.0 mm,外径1.2 mm,射程22 mm(图 1A)。
|
Download:
|
| 图 1 A:自动活检枪图片; B:超声引导穿刺进针路径(箭头指示处)图片; C:穿刺所获肿瘤组织图片 Fig. 1 A:Picture of automatic biopsy gun; B:Puncture entry path under ultrasonic guidance (as indicated by arrow); C:Harvested tumor tissue | |
穿刺由高年资超声医生进行,术前先对患儿肝脏占位及周围组织行常规超声检查,患儿取仰卧位或右前斜位,在灰阶超声和彩色多普勒超声模式下测量观察肿瘤内部回声及血流情况,选取有血流信号的实质性回声处作为穿刺活检部位,穿刺径路避开血管、肺、胃肠等重要脏器。常规消毒铺巾,超声引导下对已选定部位进行穿刺活检(图 1B),并根据肿瘤部位及毗邻关系选择合适穿刺角度,当穿刺针针尖到达肝脏肿块边缘或进入肿块一段距离后,在安全射程范围内扣动扳机,取材完毕后立即拔出活检枪。每例患儿取6~9处穿刺组织(图 1C),肉眼检测为实质性组织后送冰冻病理和石蜡病理检查。穿刺完毕后对穿刺部位加压10 min,超声检查确定穿刺部位无出血后结束操作。麻醉苏醒后患儿转回病房,予以心率、SaO2监护,术后6 h复查血常规。
穿刺后根据病理诊断结果进行化疗。术后及随访观察内容包括出血量、伤口感染情况及穿刺道肿瘤种植情况(根据复查影像学资料及手术中探查情况确定)。穿刺准确性通过同一病例穿刺组织病理和化疗后手术切除标本病理二者间的符合率进行判定,安全性通过穿刺术后并发症情况进行判定。
三、统计学处理采用SPSS 24.0进行统计学分析,服从正态分布的计量资料用(x±s)进行描述,采用χ2检验或Fisher精确概率法进行率的比较,以P < 0.05为差异有统计学意义。
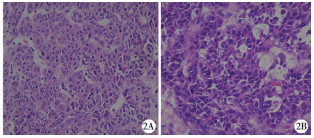
结 果每例患儿从穿刺得到的6~9处组织中选择3处送冰冻病理检查。38例中诊断为肝母细胞瘤37例,肝脏恶性肿瘤1例(免疫组化结果提示为hepatocellular malignant tumor)。其余穿刺组织送石蜡切片病理检查,组织量能够满足病理检测要求。免疫组化病理报告均与术中冰冻冻病理报告一致,但37例诊断为肝母细胞瘤患儿中仅28例报告出亚型,其中胎儿型10例,胚胎型5例,上皮型7例,混合型6例;其余9例因标本量过少未诊断出亚型。明确诊断后,2例肝母细胞瘤患儿及1例肝脏恶性肿瘤患儿放弃治疗,10例肝母细胞瘤患儿化疗中失访或放弃治疗,其余25例患儿依据化疗后行手术切除肿瘤。穿刺组织病理诊断与切除肿瘤大体标本病理诊断的完全符合(25/25)。所有病例术后未出现血红蛋白下降、心率血压改变等征象,无穿刺部位感染。随访过程中未观察到影像学检查可见的穿刺通道肿瘤种植转移。25例经化疗后评估可行肝脏肿瘤切除术,术中探查未见切口下及腹膜部位存在肉眼可及的转移灶。典型病理检查结果见图 2。
|
Download:
|
| 图 2 A:肝母细胞瘤穿刺组织病理图片; B:化疗后切除肿瘤大体标本组织病理图片(HE染色,400倍) Fig. 2 A:Pathological graph of punctured tissue of hepatoblastoma; B:Pathological graph of resected gross specimen tissue after chemotherapy (HE staining, 400 folds) | |
由于肝母细胞瘤发病隐匿,多数患儿就诊时肿瘤已无法通过手术切除[9]。故新辅助化疗在临床中逐渐得到广泛应用。参照SIOPEL规范及中国抗癌协会儿童肿瘤专业委员会儿童肝母细胞瘤多学科诊疗专家共识,对于Pretext Ⅲ期、Ⅳ期和部分Ⅱ期肿瘤患儿,条件允许的情况下都应先行肝脏肿瘤活检,明确病理诊断,给予辅助化疗后再行手术。
临床上可通过开放手术、腔镜手术、超声或CT引导穿刺活检等方式获取肝脏肿瘤标本。相比于开放手术和腔镜手术,粗针穿刺活检具有创伤小、恢复快的优点。与细针穿刺比较,粗针穿刺所获组织量较多,可满足免疫组织化学检测的需求[10],也能够有效提高病理诊断的准确性[11, 12]。故目前粗针穿刺活检在成人肿瘤(如乳腺肿瘤)中已经获得了较为广泛的应用。在儿童肿瘤诊断领域,有报道显示儿童软组织肿瘤粗针穿刺标本病理诊断正确率达97% [13]。在儿童神经母细胞瘤的诊断正确率达到100% [14],在诊断儿童甲状腺肿瘤中敏感性达85% [15]。本研究中,我们对38例儿童肝脏占位性病变实行了超声引导下的穿刺活检,术中冰冻病理诊断成功率达100%(38/38);石蜡病理对肝母细胞瘤病理亚型诊断成功率也达到75.68%(28/37);与肿瘤切除后大体标本病理诊断结果完全一致(25/25)。由此可以看出,超声引导粗针穿刺活检的准确性基本满足中国抗癌协会儿童肿瘤专业委员会《儿童肝母细胞瘤多学科诊疗规范》对儿童肝母细胞瘤诊断的要求。
超声引导儿童肝脏肿瘤粗针穿刺活检的安全性也符合儿科临床要求。因为超声引导下的穿刺可以引导进针深度,避开重要的血管、组织和器官,而且无辐射。入组患儿在穿刺术前,均由高年资B超医生对穿刺的可行性进行评估,尽量在预计手术切口路径上确定穿刺点,并用彩色多普勒选择血流相对丰富的区域作为穿刺部位。确定穿刺方案后于全身麻醉下进行穿刺,以避免穿刺过程中患儿位移的干扰。同时,为保证病理诊断获得足量的标本,每例患儿均获得至少6个部位的穿刺组织,个别多发病灶穿刺组织数可达9条。粗针穿刺的主要并发症包括大出血、伤口感染、穿刺道转移等,但发生率均较低[10, 13, 15]。本组病例也未出现。
穿刺道肿瘤种植是穿刺活检后较为罕见的一项并发症,但有研究认为之所以罕见是因为此并发症的发生难以被观察和记录下来[16, 17]。我们的穿刺规划中要求操作者尽量将穿刺点定位在预计手术切口的范围中。在25例化疗后再次行切除术的患儿中,术中探查并未发现切口皮下组织及腹膜有肉眼可见的异常肿块,随访病例中也未发现影像学可见的种植肿瘤。此外,使用穿刺活检技术的创伤较小,患儿可快速进入肿瘤化疗阶段,本研究中有7例术后1 d即进行化疗,9例术后2 d进行化疗。对于接受开放手术活检的患儿,考虑到伤口愈合的过程,通常选择行开放手术后7 d及以后进行化疗。
综上所述,超声引导下穿刺活检诊断儿童肝脏肿瘤有助于明确诊断并指导化疗方案的选择,具有安全、准确,可快速进入化疗阶段的优点。
| 1 |
Venkatramani R, Stein JE, Sapra A, et al. Effect of neoadjuvant chemotherapy on resectability of stage Ⅲ and Ⅳ hepatoblastoma[J]. Br J Surg, 2015, 102(1): 108-113. DOI:10.1002/bjs.9681. |
| 2 |
Meyers RL, Tiao G, de Ville de Goyet J, et al. Hepatoblastoma state of the art:pre-treatment extent of disease, surgical resection guidelines and the role of liver transplantation[J]. Curr Opin Pediatr, 2014, 26(1): 29-36. DOI:10.1097/MOP.0000000000000042. |
| 3 |
Kremer N, Walther AE, Tiao GM. Management of hepatoblastoma:an update[J]. Curr Opin Pediatr, 2014, 26(3): 362-369. DOI:10.1097/MOP.0000000000000081. |
| 4 |
Aronson DC, Czauderna P, Maibach R, et al. The treatment of hepatoblastoma:its evolution and the current status as per the SIOPEL trials[J]. J Indian Assoc Pediatr Surg, 2014, 19(4): 201-207. DOI:10.4103/0971-9261.142001. |
| 5 |
Geller SA. Liver:tissue handling and evaluation[J]. Methods Mol Biol, 2014, 1180: 303-321. DOI:10.1007/978-1-4939-1050-2_18. |
| 6 |
Lipnik AJ, Brown DB. Image-guided percutaneous abdominal mass biopsy:technical and clinical considerations[J]. Radiol Clin North Am, 2015, 53(5): 1049-1059. DOI:10.1016/j.rcl.2015.05.007. |
| 7 |
高永艳, 梁萍, 王旸, 等. 超声及超声引导下粗针穿刺活检诊断小儿腹部神经母细胞性肿瘤的价值[J]. 中国医学影像学杂志, 2007, 15(5): 331-333. DOI:10.3969/j.issn.1005-5185.2007.05.004. Gao YY, Liang P, Wang Y, et al. Application of color Doppler ultrasound and ultrasound-guided core needle biopsy in neuroblastoma of children[J]. Chinese J Med Imaging, 2007, 15(5): 331-333. DOI:10.3969/j.issn.1005-5185.2007.05.004. |
| 8 |
顾胜利, 朱云开. 超声引导下穿刺活检诊断小儿肝母细胞瘤[J]. 中华医学超声杂志(电子版), 2012, 9(2): 142-145. DOI:10.3877/cma.j.issn.1672-6448.2012.02.010. Gu SL, Zhu YK. Clinical value of ultrasound-guided core needle biopsy in the diagnosis of hepatoblastoma in children[J]. Chin J Med Ultrasound (Electronic Edition), 2012, 9(2): 142-145. DOI:10.3877/cma.j.issn.1672-6448.2012.02.010. |
| 9 |
Spector LG, Birch J. The epidemiology of hepatoblastoma[J]. Pediatr Blood Cancer, 2012, 59(5): 776-779. DOI:10.1002/pbc.24215. |
| 10 |
Howlett DC, Triantafyllou A. Evaluation:fine needle aspiration cytology, ultrasound-guided core biopsy and open biopsy techniques[J]. Adv Otorhinolaryngol, 2016, 78: 39-45. DOI:10.1159/000442123. |
| 11 |
Wolinski K, Stangierski A, Ruchala M. Comparison of diagnostic yield of core-needle and fine-needle aspiration biopsies of thyroid lesions:systematic review and meta-analysis[J]. Eur Radiol, 2016, 27(1): 431-436. DOI:10.1007/s00330-016-4356-9. |
| 12 |
Pyo JS, Sohn JH, Kang G. Core needle biopsy is a more conclusive follow-up method than repeat fine needle aspiration for thyroid nodules with initially inconclusive results:a systematic review and meta-analysis[J]. J Pathol Transl Med, 2016, 50(3): 217-224. DOI:10.4132/jptm.2016.02.15. |
| 13 |
Metz T, Heider A, Vellody R, et al. Image-guided percutaneous core needle biopsy of soft-tissue masses in the pediatric population[J]. Pediatr Radiol, 2016, 46(8): 1173-1178. DOI:10.1007/s00247-016-3571-5. |
| 14 |
Avanzini S, Faticato MG, Sementa AR, et al. Video-assisted needle core biopsy in children affected by neuroblastoma:a novel combined technique[J]. Eur J Pediatr Surg, 2017, 27(2): 166-170. DOI:10.1055/s-0036-1580703. |
| 15 |
Yunker WK, Hassan SF, Ferrell LB, et al. Needle core biopsy in the diagnosis of pediatric thyroid neoplasms:a single institution retrospective review[J]. Pediatr Surg Int, 2013, 29(5): 437-443. DOI:10.1007/s00383-013-3278-8. |
| 16 |
Kawasaki T, Ishida M, Tada T, et al. Well-differentiated neuroendocrine tumor of the breast with recurrence due to needle tract seeding[J]. Virchows Arch, 2015, 466(4): 479-481. DOI:10.1007/s00428-014-1704-5. |
| 17 |
Giorgadze T, Qureshi F, Aulicino M, et al. Retroperitoneal recurrence of a stage 1 renal cell carcinoma four years following core biopsy and fine needle aspiration:possible needle tract seeding[J]. Diagn Cytopathol, 2013, 41(5): 470-472. DOI:10.1002/dc.22815. |
 2019, Vol. 18
2019, Vol. 18


