肺隔离症(pulmonary sequestration, PS)是较为罕见的先天性支气管肺发育畸形,占肺部先天畸形的0.15% ~6.4%,其主要特征为胚胎时期无呼吸的功能性肺组织与正常肺组织的气管、支气管树及肺动脉相分离,呈囊性或实性团块样结构, 多位于肺下叶内,也可位于肺叶与膈肌之间,病变肺组织多由来自体循环动脉(主要是胸主动脉和腹主动脉)发出的分支血管供血[1, 2]。南京医科大学附属儿童医院以往收治的PS病例均通过传统开胸手术治疗,但随着儿童腔镜技术的发展及胸腔镜手术技术的进步,胸腔镜技术已经广泛用于儿童多种疾病的治疗[3]。与传统开胸手术相比,电视胸腔镜手术在婴幼儿肺叶切除术中具有切口美观、不影响肩关节活动与胸廓发育等优点,在婴幼儿及儿童肺叶切除术中已被广泛应用[4]。本文旨在对比开胸手术及全胸腔镜手术治疗儿童先天性肺隔离症的疗效。
材料与方法 一、临床资料2010年5月至2018年1月南京医科大学附属儿童医院共收治66例先天性肺隔离症患儿,其中男童40例,女童26例,年龄28 d至12岁9个月,平均(47.7±49.7)个月;体重2.5~57.5 kg,平均(17.9±13.3)kg;叶内型47例(71.2%),叶外型18例(27.2%),1例(1.5%)为叶内叶外并存。2例合并弯刀综合征,2例合并漏斗胸,27例合并肺囊肿,2例合并膈疝,6例合并先天性心脏病,1例合并大叶性肺气肿。叶内型主要表现为反复咳嗽、发热、胸痛、脓痰、痰中带血;叶外型无明显症状,均于体检过程中发现。所有病例术前行CT血管造影(CT angiography, CTA)明确诊断。根据手术方式分为全胸腔镜手术组(n=27)和开胸手术组(n=39)。PS典型病例各项检查结果见图 1至图 5。
|
Download:
|
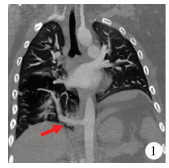
| 图 1 先天性肺隔离症患儿胸部CT冠状面图 Fig. 1 Coronal view of thoracic CT in a child of congenital pulmonary sequestration | |
|
Download:
|
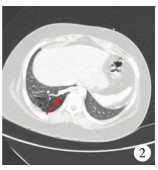
| 图 2 先天性肺隔离症患儿胸部CT横断面图 Fig. 2 Cross-sectional view of thoracic CT in a child of congenital pulmonary sequestration | |

|
Download:
|
| 图 3 先天性肺隔离症患儿CT血管图 Fig. 3 CT angiography in a child of congenital pulmonary sequestration | |
|
Download:
|
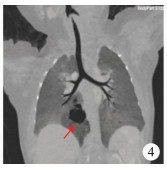
| 图 4 先天性肺隔离症患儿肺囊性病变图 Fig. 4 Cystic lung lesion in a child of congenital pulmonary sequestration | |
|
Download:
|
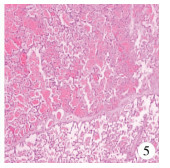
| 图 5 先天性肺隔离症患儿术后隔离肺病理结果 Fig. 5 Postoperative pathological graph in a child of congenital pulmonary sequestration | |
开胸手术组:常规消毒铺单,取健侧卧位,胸部加垫以抬高患侧胸腔,单腔气管插管,对于4月龄以下患儿采用双肺通气,静脉吸入复合全身麻醉,手术切口为后外侧切口,长度6~8 cm。术中见30例为叶外型,行隔离肺切除术;9例为叶内型,予肺段或者楔形切除术。隔离肺异常血管均来自降主动脉。
全胸腔镜手术组:除2例4月龄以内患儿外,其余病例均采用支气管封堵技术单肺通气完成手术。术前准备同普通胸外科手术,术中采用健侧卧位,腰部垫高。使用3 mm微型胸腔镜,置入胸腔镜时选择单肺、低潮气量通气,避免损伤胸腔内重要脏器,并为手术腾出足够的操作空间。根据胸部疾病位置选择观察孔及操作孔的部位,一般选择3个穿刺孔,观察孔远离病灶,与操作孔形成倒三角形,避免器械相互干扰。在术侧胸腔,以4~6 mmHg压力充气作人工气胸,根据患儿情况调整压力。27例中, 17例叶内型和10例叶外型隔离肺分别行肺段、肺楔形及隔离肺切除术,1例因合并大叶性肺气肿行肺叶切除术。27例异常血管均来自主动脉。
三、统计学处理采用SPSS 13.0进行统计学分析,手术时间、术中出血量、术后住院时间、术后引流量及术后引流管留置时间等计量资料采用(x±s)表示,两组间比较采用独立样本t检验,以P < 0.05为差异有统计学意义。
结 果两组患儿均顺利完成手术,27例全胸腔镜下手术患儿中,1例因胸腔粘连严重中途改为开胸手术。其余均在全胸腔镜下完成手术,叶内型根据病灶情况,分别行肺叶、肺段或肺叶楔形切除术,叶外型行隔离肺切除术。2例合并弯刀综合征患儿同时行心内畸形矫治手术。合并漏斗胸者在肺叶切除后同时行漏斗胸Nuss手术;合并膈疝者在腔镜辅助下行膈疝修补术;4例合并先天性心脏病的患儿中,3例因房间隔缺损行胸前封堵手术,1例因室间隔缺损行体外循环下手术;1例合并大叶性肺气肿及27例合并肺囊肿的患儿同时行肺叶或肺段切除术。
传统开胸手术组39例中,叶内型行肺段、肺叶楔形切除及肺叶切除术,叶外型行隔离肺切除术。手术时间90~163 min,平均(110±15.9)min;术中出血量40~110 mL,平均(70±10.91)mL;术后住院时间8~13 d,平均(10±1.6)d;术后引流量70~130 mL,平均(90±16.6)mL;术后引流管留置时间4~9 d,平均(6±1.28) d。胸腔镜手术组手术时间76~145 min,平均(80±5.6)min;术中出血量10~40 mL,平均(20±9.2)mL;术后住院时间3~9 d,平均(5.1±2.1)d;术后引流量30~80 mL,平均(50±9.6)mL;术后引流管留置时间2~6 d,平均(4±1.3)d。胸腔镜手术组手术时间、术中出血量、术后住院时间、术后引流量及术后引流管留置时间均明显低于开胸手术组,差异有统计学意义(P < 0.05),见表 1。
|
|
表 1 两组患儿手术情况比较 Table 1 Comparison of surgical profiles between two groups |
肺隔离症的主要特点是胚胎期间部分肺组织与主肺分开,产生无肺功能的囊性包块,并从体循环动脉(主要是胸主动脉和腹主动脉)获得血供。根据异常肺组织与正常胸膜包裹情况可分为肺叶内型(intralobar pulmonary sequestration, ILS)及肺叶外型(extralobar pulmonary sequestration, ELS),混合型很少见。叶内、叶外型肺隔离症的回流静脉有所不同,叶内型的静脉通常回流到肺静脉,尤其是下肺静脉;叶外型肺隔离症常回流到奇静脉和半奇静脉,或经腔静脉至右房。对于ILS,隔离肺和正常肺叶包裹在同一脏层胸膜中,其囊内病变与正常支气管可能相通,易导致反复肺部感染。而ELS有独立内脏胸膜,因囊内病变不与正常支气管树沟通,因此可以长时间不表现出任何症状[5-7]。
1902年,Eppinger和Schauenstein等[8]发现PS存在独立血供的肺胚芽组织,并称其为副肺胚芽,该组织可随正常肺组织发育。如果副肺胚芽出现在胚胎期早期或胸膜发育之前,则发育为叶内型肺隔离症;如果副肺胚芽与邻近的新生肺已形成分离或发育较晚,则发育为叶外型肺隔离症。1946年,Pryce提出牵引学说,认为肺组织发生脱离时,与主动脉相连的原肠、肺胚芽周围的内脏毛细血管吸收不全以及牵引部分胚胎肺组织是形成肺隔离症的主要机制。但该学说仅可解释肺外隔离症,不能解释肺内隔离症和儿童交通性支气管肺前肠畸形(communicating bronchopulmonary foregut malformation, CBPFM)[9]。Gebaeur和Mason等[10]提出肺隔离症可能由于肺组织局部感染引起。1984年,Stocker和Malczak等[11]通过实验研究表明PS为后天获得性感染所致,并提出肺隔离症患者的肺韧带及肺动脉与正常人相同,长期感染可阻塞支气管或闭塞肺动脉,导致局部动脉膨大,形成异常供血动脉。感染可通过肺泡间隙及支气管肺泡连接处扩散到隔离肺段,最终形成获得性ILS,但ELS的形成还未得到验证。同时母体营养不良、酗酒、药物成瘾及胎儿时期呼吸运动、肺液异常等均可能对肺发育起负面作用[12, 13]。肺隔离症的发病机制目前尚缺乏充分的动物实验研究。
二、肺隔离症诊断方法近年来随着多层螺旋CT的广泛应用及产前超声筛查的普及,PS的确诊率已明显提高。在胎儿超声检查中,肺隔离症主要表现为边界清晰、高回声、致密且密度分布均匀的肿块。此外,通过彩色多普勒探查发现胎儿肺部病变动脉起自主动脉也有助于胎儿BPS的诊断。胸部X线片仅能显示均匀的肺部肿块或囊肿病灶,特异性不高。血管造影作为诊断肺隔离症的金标准,可确定从体循环动脉分出至隔离肺的异常血管,但其具有侵入性、耗时、昂贵、风险性较大等缺点。
CTA是一种非侵入性检查,其安全性、有效性与血管造影基本没有差别。它不仅可以准确地描绘出异常动脉起源及静脉系统回流异常,还可评估肺实质及气管情况,具有无创、用时短、空间分辨率高等优点,可作为诊断肺隔离症首选的无创方法[1, 14]。尽管有很多研究评估了CTA作为PS诊断技术的有效性和安全性,但很少有研究评估CTA替代血管造影的临床意义。多探测器计算机断层扫描血管造影术(multi-detector computed tomography, MDCT)有助于肺隔离症的诊断,该技术可同时显示隔离肺组织、气道变化、动脉血供(尤其是小动脉、静脉回流情况),为手术策略的制定提供帮助,有望成为术前评估肺隔离症的一线检查方法[15]。近年来,MRI对肺隔离症显影的清晰度越来越好,准确率越来越高,因此对于超声诊断不明确或需要更详细的评估时,可进一步行MRI检查[16]。CTA扫描时间明显短于MRI,虽较MRI辐射危险略大,但儿童行MRI检查需要明显延长镇静时间及治疗时间,故许多研究者仍优先推荐采用CTA诊断疑似肺隔离症患儿[7]。本组患儿均在术前通过CTA明确诊断,无一例误诊。
三、手术方法肺隔离症的治疗目前仍以手术切除为主。虽然有10%左右的肺隔离症患儿无症状,但许多专家建议,一旦明确诊断,患儿就需手术治疗,发生感染的患者在感染控制后1~2周内就可以接受手术治疗。肺隔离症的最佳手术年龄为3至6月龄,主要与下列因素有关:①肺隔离症可能发展为真菌或者结核感染,病情可能随年龄增长而加重,严重者可发展为致命性咯血甚至癌变;②肺隔离症在局部区域的反复感染可能引起血流动力学改变、血氧异常和肺组织纤维化等;③肺隔离症患儿合并其他畸形往往需要同期接受手术;④研究表明,出生后6个月内行肺叶切除者肺组织可代偿性生长;⑤随着围术期重症监护技术的进步,术后并发症的发生率已明显降低[6]。在肺叶处理方式上,叶内型常合并支气管扩张、真菌感染甚至恶性肿瘤,一般行肺叶切除更为安全,而叶内型如果病变局限可以选择肺段式切除。在手术过程中,供血动脉常隐藏在下肺韧带,因此在处理下肺韧带时需特别谨慎[17]。
近年来,随着手术技术的进步及胸腔镜技术的快速发展,可通过腔镜完成儿童肺叶切除[17, 18]。电视辅助胸腔镜技术治疗具有手术和住院时间较短、术中出血量少、痛苦小、对患儿心理发育影响较小等优点。近年来,随着机器人技术快速发展,电视辅助胸腔镜技术将成为肺隔离症微创治疗的重要发展方向。机器人手术虽具有精准、稳定等优势,但其维修耗费大,经济效益差,因此暂时还不能大规模临床应用[22]。
综合本组病例的诊疗经过,总结经验如下:①手术时机的选择:一经诊断即建议手术,产前及新生儿期诊断者建议于3至6月龄时手术;②在手术过程中,分清动脉和静脉解剖关系至关重要,供养动脉常隐藏于下肺韧带或黏附于胸壁,手术过程中最重要的是找出这些异常动脉及其分支;由于肺部反复感染和异常血管的存在,术中很容易造成难以控制的大出血,所以手术成功的关键是要处理好来自体动脉的分支血管; ③手术时要防止异常血管缩回到纵隔胸膜及膈肌,特别是起源于腹部动脉的异常血管,一旦回缩极其危险,很容易造成大出血。如果遇见管径粗的血管,建议结扎后加用5 - 0 prolene线缝合,防止发生大出血;同时术前明确供血血管来源也是非常重要的,术中应仔细寻找异常血管,避免盲目钳夹和切断缝扎;④对于较粗的异常血管,术前需用CTA测量管径、数量,做到心中有数,减少出血的发生; ⑤肺隔离症常合并其它畸形,因此在游离周围组织时,应避免损伤食管、气管等,同时需注意肋间动脉的保护。在进行同期合并症手术时,应尽量使创伤最小化。儿童肺组织较为娇嫩,在行电视胸腔镜手术时,应尽量做到操作简单、轻柔、迅速;切除隔离肺及肺囊肿时,最好使用一次性钉匣或超声刀,避免复杂操作。如果选择胸腔镜手术,一旦发生大出血、胸腔粘连等严重情况,应立即终止并转为开胸手术; ⑥介入治疗是PS治疗的新方法,可用明胶海绵或弹簧圈栓塞异常血管,但此方法仅适用于血管直径2~5 mm的患儿。
| 1 |
Chien KJ, Huang TC, Lin CC, et al. Early and late outcomes of coil embolization of pulmonary sequestration in children[J]. Circ J, 2009, 73(5): 938-942. DOI:10.1253/circj.CJ-08-0914. |
| 2 |
Gezer S, Tastepe I, Sirmali M, et al. Pulmonary sequestration:a single-institutional series composed of 27 cases[J]. J Thorac Cardiovasc Surg, 2007, 133(4): 955-959. DOI:10.1016/j.jtcvs.2006.11.003. |
| 3 |
Rogers DA, Philippe PG, Lobe TE, et al. Thoracoscopy in children:an initial experience with an evolving technique[J]. J Laparoendosc Surg, 1992, 2(1): 7-14. DOI:10.1089/lps.1992.2.7. |
| 4 |
Park S, Kim ER, Hwang Y, et al. Serial improvement of quality metrics in pediatric thoracoscopic lobectomy for congenital lung malformation:an analysis of learning curve[J]. Surg Endosc, 2017, 31(10): 3932-3938. DOI:10.1007/s00464-017-5425-0. |
| 5 |
Tashtoush B, Memarpour R, Gonzalez J, et al. Pulmonary sequestration:a 29 patient case series and review[J]. J Clin Diagn Res, 2015, 9(12): AC05-08. DOI:10.7860/JCDR/2015/16004.7006. |
| 6 |
Ou J, Lei X, Fu Z, et al. Pulmonary sequestration in children:a clinical analysis of 48 cases[J]. Int J Clin Exp Med, 2014, 7(5): 1355-1365. |
| 7 |
Lin CH, Chuang CY, Hsia JY, et al. Pulmonary sequestration-differences in diagnosis and treatment in a single institution[J]. J Chin Med Assoc, 2013, 76(7): 385-389. DOI:10.1016/j.jcma.2013.04.002. |
| 8 |
Pryce DM, Sellors TH, Blair LG. Intralobar sequestration of lung associated with an abnormal pulmonary artery[J]. Br J Surg, 1947, 35(137): 18-29. DOI:10.1002/bjs.18003513704. |
| 9 |
Pryce DM. Lower accessory pulmonary artery with intralobar sequestration of lung:a report of seven cases[J]. J Pathol Bacteriol, 1946, 58(3): 457-467. |
| 10 |
Gebauer PW, Mason CB. Intralobar pulmonary sequestration associated with anomalous pulmonary vessels:a nonentity[J]. Dis Chest, 1959, 35(3): 282-288. DOI:10.1378/chest.35.3.282. |
| 11 |
Yue SW, Guo H, Zhang YG, et al. The clinical value of computer tomographic angiography for the diagnosis and therapeutic planning of patients with pulmonary sequestration[J]. Eur J Cardiothorac Surg, 2013, 43(5): 946-951. DOI:10.1093/ejcts/ezs484. |
| 12 |
Bush A, Hogg J, Chitty LS. Cystic lung lesions-prenatal diagnosis and management[J]. Prenat Diagn, 2008, 28(7): 604-611. DOI:10.1002/pd.2039. |
| 13 |
Azizkhan RG, Crombleholme TM. Congenital cystic lung disease:contemporary antenatal and postnatal management[J]. Pediatr Surg Int, 2008, 24(6): 643-657. DOI:10.1007/s00383-008-2139-3. |
| 14 |
Hirai S, Hamanaka Y, Mitsui N, et al. Surgical treatment of infected intralobar pulmonary sequestration:a collective review of patients older than 50 years reported in the literature[J]. Ann Thorac Cardiovasc Surg, 2007, 13(5): 331-334. |
| 15 |
Long Q, Zha Y, Yang Z. Evaluation of pulmonary sequestration with multidetector computed tomography angiography in a select cohort of patients:A retrospective study[J]. Clinics (Sao Paulo), 2016, 71(7): 392-398. DOI:10.6061/clinics/2016(07)07. |
| 16 |
Li Z, Zhu M, Dong S, et al. Clinical value of prenatal MRI in the diagnosis and differential diagnosis of fetal bronchopulmonary sequestration[J]. Zhonghua Fu Chan Ke Za Zhi, 2016, 51(1): 23-26. DOI:10.3760/cma.j.issn.0529-567X.2016.01.006. |
| 17 |
Liu HS, Li SQ, Qin YZ, et al. Surgical treatment of intralobar pulmonary sequestration[J]. Chin Med Sci J, 2010, 25(1): 53-56. |
| 18 |
Rothenberg SS, Middlesworth W, Kadennhe-Chiweshe A, et al. Two decades of experience with thoracoscopic lobectomy in infants and children:standardizing techniques for advanced thoracoscopic surgery[J]. J Laparoendosc Adv Surg Tech A, 2015, 25(5): 423-428. DOI:10.1089/lap.2014.0350. |
| 19 |
Diks J, Schutte PR, Cheung D, et al. Treatment of pulmonary sequestrations by means of endovascular embolization:future or fashion?[J]. Case Rep Med, 2011, 2011: 173918. DOI:10.1155/2011/173918. |
 2019, Vol. 18
2019, Vol. 18


