通信作者:陈杰,Email: jiechen1974@163.com; 许文燮,Email:wenxiexu@sjtu.edu.cn
1.上海交通大学医学院基础医学院解剖与生理学系(上海市,200240); 2.上海交通大学医学院附属新华医院小儿外科(上海市,200092); 3.嘉兴市妇幼保健院小儿外科(上海新华医院小儿外科嘉兴分部)(浙江省嘉兴市,314000)
Hirschsprung病; Rho激酶; 肌细胞, 平滑肌; 收缩; 结肠
1.Department of Anatomy & Physiology,Shanghai Jiaotong University School of Medicine,Shanghai 200240,China; 2.Department of Pediatric Surgery,Xinhua Hospital Affiliated to Shanghai Jiaotong University School of Medicine,Shanghai 200092,China; 3.Department of Pediatric Surgery,Jiaxing Maternity and Child Health Care Hospital(Department of Pediatric Surgery,Xinhua Hospital,Jiaxing Branch),Jiaxing 314000,China. Corresponding author:Chen Jie,Email:jiechen1974@163.com; wenxiexu@sjtu.edu.cn
Hirschsprung Disease; Rho Kinase Signaling Pathway; Myocytes, Smooth Muscle; Constriction; Colon
DOI: 10.3969/j.issn.1671— 6353.2018.03.014
备注
通信作者:陈杰,Email: jiechen1974@163.com; 许文燮,Email:wenxiexu@sjtu.edu.cn
引言
先天性巨结肠(Hirschsprung's disease,HD)是一种常见的消化道发育异常疾病,也是新生儿发生肠梗阻的常见病因,发病率为1:5 000[1]。其发病机制主要是由于相关基因病变导致肠神经发育异常结肠远段缺乏神经节细胞,致使肠管失去正常蠕动,呈痉挛状态[1]。目前HD患儿肠管出现动力障碍的病理生理机制尚未完全阐明。关于HD患者结肠动力障碍机制的研究,目前多是以肠神经系统(ENS)发育异常为前提,涉及Cajal间质细胞(ICC细胞)和PDGFRα+细胞以及平滑肌细胞这三种与胃肠动力调节密切相关的三大因素[2-4]。很少有研究单纯从平滑肌细胞的角度来反映HD病变部位的情况。神经递质或体液因素等作用于平滑肌细胞后,主要通过“钙依赖”途径和“钙敏化”途径产生收缩反应。有报道HD患儿无神经节肠段中肌层平滑肌细胞结构异常[5]; 研究人员在HD大鼠模型上观察到,“钙敏化”途径主要是RhoA/Rho激酶(RhoK,ROCK)信号通路,其在病变肠管的活性相对于正常肠管和扩张肠管均增加[6]。但在HD患者的结肠平滑肌上相关研究少。本实验观察HD患者扩张段和狭窄段结肠的RhoA/ROCK信号通路中主要蛋白表达的变化,以期为探讨HD患者结肠动力紊乱的机制提供新的视角。
1 材料与方法
1.1 临床资料选择2017年7月1日至2017年12月1日在本院治疗HD患儿9例,均根据病史、钡剂灌肠、术中冰冻切片和术后病理检查等确诊为先天性巨结肠。患儿年龄6个月至2岁。男3例,女6例; 常见型6例,长段型3例。均行巨结肠根治术,每例取扩张段和病变段(狭窄段)组织各一块,立即在生理盐水中去除黏膜层和黏膜下层。用生理盐水洗净后置于标记好的冻存管中放于-80℃保存,以备所有标本一起检测。以扩张段近端肠管做自身对照。
1.2 主要设备和试剂中国上海净信公司全自动样品快速研磨仪,中国香港力康公司台式高速冷冻离心机,美国BIO-RAD公司凝胶电泳仪、转印电泳槽、超高灵敏度化学发光成像系统。美国Sigma公司蛋白酶抑制剂和磷酸酶抑制剂,美国CST公司MLC20抗体、P(Ser19)-MLC20抗体、MYPT1抗体、P(Thr853)-MYPT1抗体、GAPDH抗体,美国Abcam公司ROCK1抗体、ROCK2抗体。
1.3 实验方法使用Western-blotting方法检测与RhoA/ROCK信号通路相关蛋白的表达水平。取结肠组织100 mg,加入1 mL RIPA裂解液、10 μL蛋白酶抑制剂和10 μL磷酸酶抑制剂,匀浆后冰上放置30 min; 4℃ 离心后取上清,采用BSA法测定蛋白浓度并将各样本浓度稀释为5 μg/μL,于-80℃保存。各取样本10 μL加入上样缓冲液,混合后100℃煮沸5 min,分别经7.5%和10% SDS-PAGE电泳,90 V-2 h电转; 电转结束后取PVDF膜,置于封闭液中室温封闭2 h。封闭结束后,分别4℃ 孵育一抗[MLC20、P(Ser19)-MLC20、MYPT1、P(Thr853)-MYPT1、GAPDH均1:1 000稀释; ROCK1 1:10 000稀释使用、ROCK2 1:50 000稀释使用]过夜。加入二抗(1:2 000稀释)室温孵育1.5 h。加显色液曝光。
1.4 统计学处理使用软件Quantity One计算条带的灰度值,用GAPDH条带的灰度值做内对照进行校正,分别计算出各样本的相对表达量。采用SPSS 22对数据进行分析。计量资料用均数±标准差(x^-±s)表示。扩张段和狭窄段肠壁组织中各蛋白表达水平的比较采用配对t检验,以P<0.05为差异有统计学意义。
2 结 果
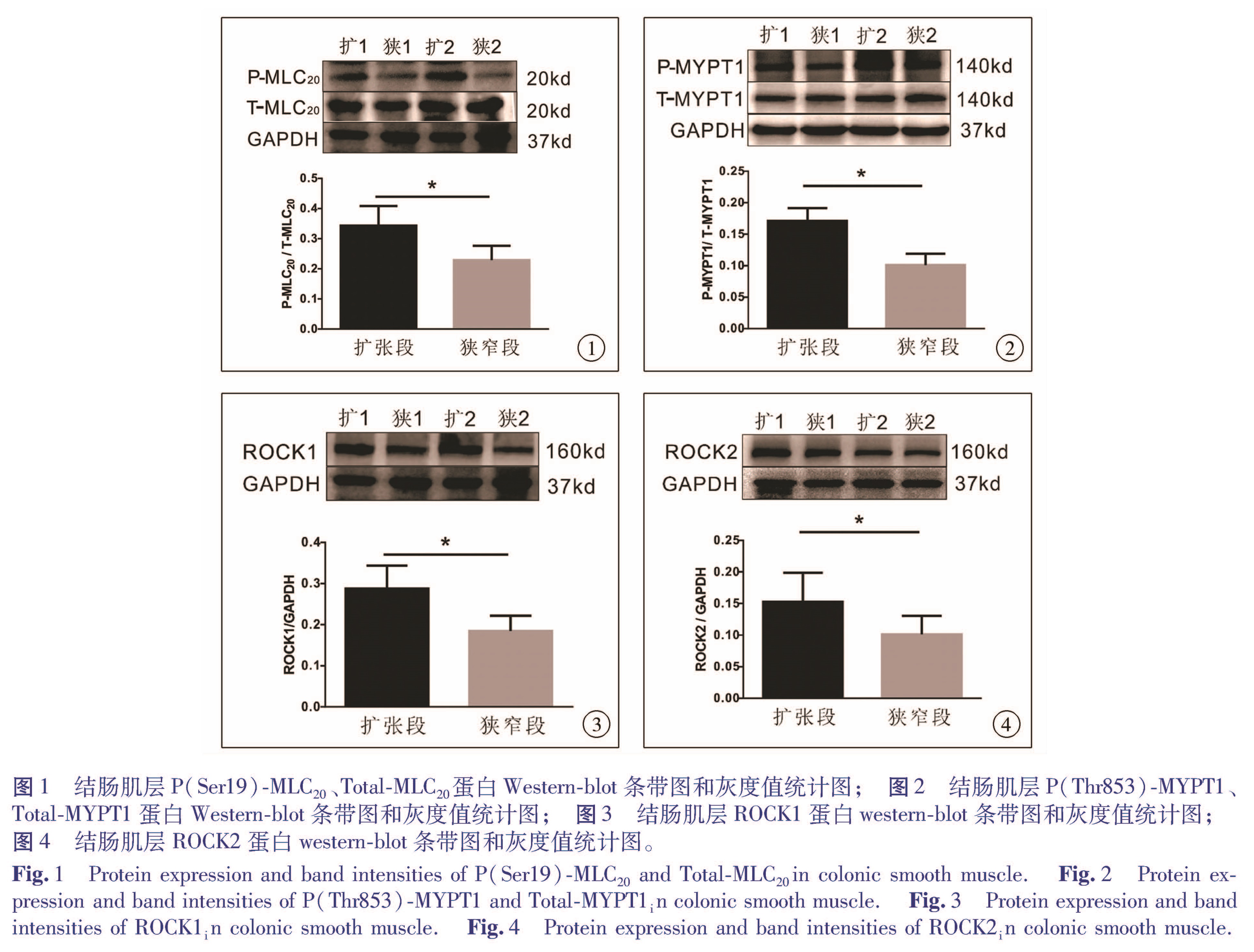
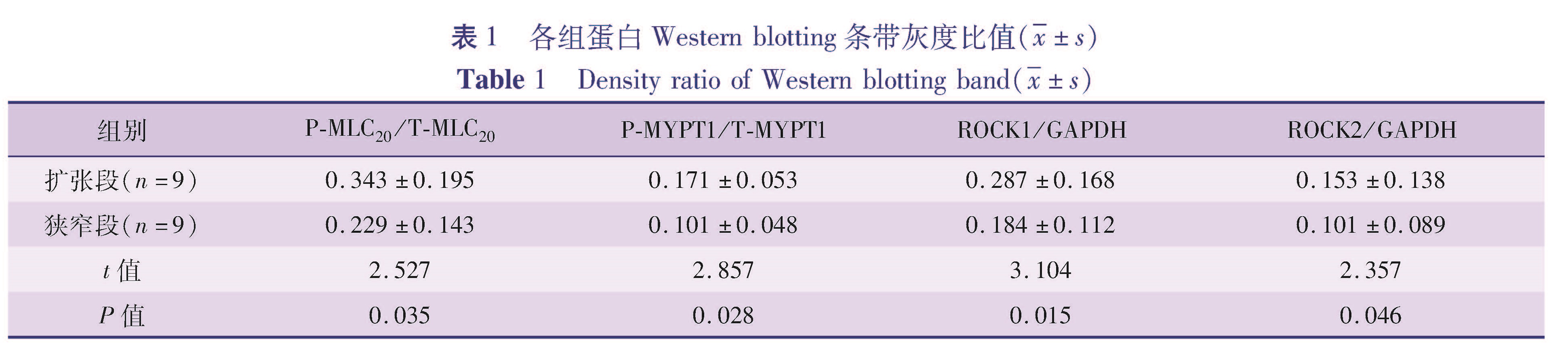
Western Blotting结果显示,与RhoA/ROCK信号通路相关的蛋白在HD患儿肠管的扩张段和狭窄段均有表达。9例患者狭窄段P(Ser19)-MLC20的表达量(0.229±0.143)整体低于自身扩张段的表达(0.343±0.195),差异有统计学意义(t=2.527,P=0.035,图1); 患者狭窄段P(Thr853)-MYPT1的表达量(0.101±0.048)低于自身扩张段的表达(0.171±0.053),差异有统计学意义(t=2.857,P=0.028,图2); 9例患者狭窄段ROCK1的表达水平(0.184±0.112)均低于自身扩张段的表达(0.287±0.168),差异有明显统计学意义(t=3.104,P=0.015,图3); 9例患者狭窄段ROCK2的表达水平(0.101±0.089)整体低于自身扩张段的表达(0.153±0.138),差异有统计学意义(t=2.357,P=0.046,图4)。各蛋白表达情况见表1。
3 讨 论
HD的主要发病机制是肠道末端的一段肠壁中神经节细胞缺失,导致该段肠管持续异常收缩,而临近的上段结肠仍然保持蠕动功能,结果导致上段结肠代偿性扩张、肥厚,最终形成巨结肠,因此该病又称无神经节细胞症[7]。
图1 结肠肌层P(Ser19)-MLC20、Total-MLC20蛋白Western-blot条带图和灰度值统计图; 图2 结肠肌层P(Thr853)-MYPT1、Total-MYPT1蛋白Western-blot条带图和灰度值统计图; 图3 结肠肌层ROCK1蛋白western-blot条带图和灰度值统计图; 图4 结肠肌层ROCK2蛋白western-blot条带图和灰度值统计图。
Fig.1 Protein expression and band intensities of P(Ser19)-MLC20 and Total-MLC20 in colonic smooth muscle.Fig.2 Protein expression and band intensities of P(Thr853)-MYPT1 and Total-MYPT1 in colonic smooth muscle.Fig.3 Protein expression and band intensities of ROCK1 in colonic smooth muscle.Fig.4 Protein expression and band intensities of ROCK2 in colonic smooth muscle.近20年来关于巨结肠的研究中,许多学者致力于探究ENS及消化道起搏细胞ICC。其中ENS释放多种神经递质,通过神经递质直接或者间接作用于平滑肌细胞,从而影响其收缩。在HD患者的病变肠段中,目前研究认为存在多种神经递质的释放异常,如肾上腺素能神经递质释放减少、一氧化氮合酶神经递质释放减少、胆碱能神经递质释放增多等[8]。这些神经递质的改变均通过影响平滑肌的收缩,最终对胃肠蠕动产生影响。另一方面,ICC不仅作为起搏细胞,将自发产生的节律性电兴奋传给临近的平滑肌细胞,使其去极化并产生慢波和快波,引起平滑肌收缩,使胃肠道产生节律性运动,也介导了神经信号的传递[9]。在多种消化道动力障碍性疾病的发生过程中,ICC细胞形态和功能的改变起到了关键性作用,其发育异常可能是一些儿童胃肠道疾病如先天性巨结肠发病的重要因素[10]。
此外,随着对PDGFRα+细胞形态和功能研究日益深入,2012年Sang Don Koh [11]首先在消化道平滑肌兴奋性的研究中提出了SIP合胞体(平滑肌/ICC/PDGFRα+细胞)的概念,认为胃肠道平滑肌的节律性收缩是外来神经、肠内神经丛与SIP合胞体协调作用的结果,即肠运动神经释放神经递质作用于肌层中ICC、PDGFRα+细胞这两种间质细胞,并且通过间质细胞与平滑肌细胞之间的缝隙连接进一步影响平滑肌运动[12]。也有越来越多的研究表明,在HD患儿无神经节细胞的肠段中,PDGFRα+细胞的功能发生了变化[12,13]。
综上所述,无论是ENS,还是SIP合胞体,最终都是通过影响平滑肌收缩来影响胃肠运动。衡量平滑肌收缩程度的一个重要因素即是肌球蛋白轻链(MLC20)的磷酸化水平。一般而言,结肠肌层的平滑肌细胞在受到外界刺激时,主要是通过“钙依赖”途径和“钙敏化”途径影响MLC20的磷酸化(图5)。“钙依赖”途径的大致过程是,在平滑肌细胞受到刺激后,胞外的Ca2+通过L-型钙通道进入胞内,与钙调蛋白结合,激活肌球蛋白轻链激酶(MLCK),促使MLC20磷酸化增加,平滑肌细胞发生收缩反应; 而“钙敏化”途径主要是RhoA/ROCK信号通路,外界刺激通过胞膜上的G蛋白偶联受体,经RhoA及其底物ROCK的介导,促使肌球蛋白轻链磷酸酶(MLCP)的亚基MYPT1发生磷酸化使MLCP自身的活性被抑制,MLCP的活性被抑制后可抑制MLC20的去磷酸化过程,间接增加MLC20的磷酸化水平,促进平滑肌收缩[11,14]。这两条途径相互协调,最终完成平滑肌的收缩反应。然而,目前在HD发病机制的研究中,ENS、ICC细胞和PDGFRα+功能的改变,对肌层平滑肌细胞自身产生了怎样的影响,尤其是与这两条途径相关的影响,少有研究报道。近年来有研究发现,在HD无神经节细胞肠段中,肌层的平滑肌细胞存在层粘蛋白、结蛋白、纽蛋白、营养不良蛋白和εSG的缺失,smoothelin蛋白表达减少,这些蛋白主要在平滑肌细胞的增殖分化阶段发挥作用[15]。同时Won KJ等[16]的研究指出,HD大鼠巨结肠病变部位相较于正常大鼠结肠对应的部位,其肌层厚度增加明显,可能存在平滑肌细胞过度增殖。此外,周小琴等[17]对HD患儿病变段肌层组织进行α-SMA免疫染色发现,病变段平滑肌细胞α-平滑肌肌动蛋白(α-SMA)染色相对于正常肠段染色较浅,α-SMA表达减少。α-SMA是由成熟平滑肌细胞表达的与肠蠕动密切相关的收缩蛋白之一。这些均提示HD病变肠管的平滑肌细胞本身可能存在发育和功能的异常。而在本实验中,我们发现9例HD患儿狭窄段的肠壁肌层中,与RhoA/ROCK信号通路相关的蛋白表达(ROCK1,ROCK2,P(Thr853)-MYPT1)均比自身扩张段减少。说明在HD患儿狭窄段的平滑肌细胞中,相较于扩张段,RhoA/ROCK信号通路反应性是减弱的,这与在大鼠模型中观察到的结果相反[6]。ROCK包括ROCK1和ROCK2两种亚型; ROCK1主要分布于肝、肾、肺等组织器官中,与组织细胞的生长和凋亡相关; ROCK2主要在肌肉组织和脑组织中表达,其在MLCP介导的细胞骨架构建过程中发挥重要的作用[18]。可见,在平滑肌细胞正常的收缩过程中,主要是ROCK2参与“钙敏化”途径。而我们的结果表明,在HD狭窄段,ROCK1和ROCK2的表达均是降低的。Coyle D等[19]研究发现,在HD患儿无神经节细胞的肠段中,ROCK1的表达减少,ROCK2蛋白未发生明显改变,这和我们的研究结果部分一致,说明在HD患儿病变肠段中,ROCK的功能可能也发生了变化。
另一方面,有研究表明在HD患儿无神经节细胞的肠壁中,肌层平滑肌细胞表面的L-型钙通道的表达、电流强度和电流密度与有神经节细胞的肠段相比,并没有明显区别[20]。L-型钙通道是胞外Ca2+进入胞内,引起平滑肌细胞通过“钙依赖”途径收缩的重要通道,说明“钙依赖”途径在无神经节细胞的肠壁中可能并没有受到影响。且有研究指出,在病变肠段中,存在多种神经递质释放异常,主要是兴奋性神经递质释放增多[7]。乙酰胆碱(Ach)是胃肠道最主要的兴奋性神经递质,由于胆碱能神经纤维的增生,Ach释放增多[21]。释放的Ach可促使胞外的Ca2+通过L-型钙通道进入平滑肌细胞内,引发“钙依赖”途径,促使平滑肌细胞收缩。因此,这些均可能是HD病变段表现出痉挛状态的原因。
本研究表明,HD患儿肠段中,相对于扩张段,狭窄段肌层平滑肌细胞RhoA/ROCK信号通路减弱,“钙依赖”途径较强,提示在结肠平滑肌中“钙依赖”途径和“钙敏化”途径存在功能失衡,这可能是HD无神经节肠段平滑肌收缩异常的内在机制。
-
1 Langer JC.Hirschsprung disease[J].Curr Opin Pediatr,2013,25(3):368 — 374.DOI:10.1097/MOP.0b013e328360c2a0.
-
2 汤绍涛,曹国庆.先天性巨结肠症的诊治现状[J].临床小儿外科杂志,2012,11(1):62 — 64.DOI:10.3969/j.issn.1671 — 6353.2012.01.026.
-
3 Mckeown SJ,Stamp LA,Hao MM,et al.Hirschsprung disease:a developmental disorder of the enteric nervous system[J].Wiley Interdiscip Rev Dev Biol,2013,2(1):113 — 129.DOI:10.1002/wdev.57.
-
4 Tjaden NE,Trainor PA.The developmental etiology and path-ogenesis of Hirschsprung disease[J].Transl Res,2013,162(1):1 — 15.DOI:10.1016/j.trsl.2013.03.001.
-
5 Nemeth L,Rolle U,Puri P.Altered cytoskeleton in smooth muscle of aganglionic bowel[J].Arch Pathol Lab Med,2002,126(6):692 — 696.DOI:10.1043/0003 — 9985(2002)126<0692:ACISMO>2.0.CO; 2
-
6 Akiyoshi J,Ieiri S,Nakatsuji T,et al.Mechanism of Rho-kinase-mediated Ca2+-independent contraction in aganglionic smooth muscle in a rat model of Hirschsprung's disease[J].Pediatr Surg Int,2009,25(11):955 — 960.DOI:10.1007/s00383 — 009 — 2461 — 4.
-
7 吴小红.SOX10蛋白在先天性巨结肠肠壁中的表达[J].实用临床医药杂志,2011,15(21):189 — 190.DOI:10.3969/j.issn.1672 — 2353.2011.21.085.
-
8 黄发新,刘磊.神经递质异常在先天性巨结肠生理变化中的作用[J].临床小儿外科杂志,2015,14(2):142 — 144.DOI:10.3969/j.issn.1671 — 6353.2015.02.018.
-
9 宋妮娜,许文燮.胃肠平滑肌运动单位SIP合胞体的生理与病理生理学意义[J].生理学报,2016,68(5):621 — 627.DOI:10.13294/j.aps.2016.0073.
-
10 Haase AM,Gregersen T,Christensen LA,et al.Regional gastrointestinal transit times in severe ulcerative colitis[J].Neurogastroenterol Motil,2016,28(2):217 — 24.DOI:10.1111/nmo.12713.
-
11 Sanders KM,Koh SD,Ro S,et al.Regulation of gastrointestinal motility-insights from smooth muscle biology[J].Nat Rev Gastroenterol Hepatol,2012,9(11):633 — 645.DOI:10.1038/nrgastro.2012.168.
-
12 O'Donnell AM,Coyle D,Puri P.Deficiency of platelet-derived growth factor receptor-α-positive cells in Hirsch-sprung's disease colon[J].World J Gastroenterol,2016,28; 22(12):3335 — 40.DOI:10.3748/wjg.v22.i12.3335.
-
13 Coyle D,O'Donnell AM,Puri P.Altered distribution of small-conductance calcium-activated potassium channel SK3 in Hirschsprung's disease[J].J Pediatr Surg,2015,50(10):1659 — 64.DOI:10.1016/j.jpedsurg.2015.01.013.
-
14 Perrino BA.Calcium Sensitization Mechanisms in Gastrointestinal Smooth Muscles[J].J Neurogastroenterol Motil,2016,22(2):213 — 225.DOI:10.5056/jnm15186.
-
15 沈涤华,施诚仁,吴晔明,等.先天性巨结肠患儿肠道内Smoothelin的表达[J].中华小儿外科志,2017,38(4):288 — 291.DOI:10.3760/cma.j.issn.0253 — 3006.2017.04.010.
-
16 Won KJ,Torihashi S,Mitsui-Saito M,et al.Increased smooth muscle contractility of intestine in the genetic null of the endothelin ETB receptor:a rat model for long segment Hirschsprung's disease[J].Gut,2002,50(3):355 — 360.DOI:10.1136/gut.50.3.355.
-
17 周小琴,牛丽文,陶强,等.先天性巨结肠相关标志物的研究及意义[J].南昌大学学报(医学版),2014,(6):12 — 15,20.DOI:10.13764/j.cnki.ncdm.2014.06.004.
-
18 Wang S,Chen C,Su K,et al.Angiotensin II induces reorganization of the actin cytoskeleton and myosin light-chain phosphorylation in podocytes through rho/ROCK-signaling pathway[J].Renal Failure,2015,38(2):268 — 275.DOI:10.3109/0886022X.2015.1117896.
-
19 Coyle D,O'Donnell AM,Corcionivoschi N,et al.Rho-kinase expression in Hirschsprung's disease[J].Pediatr Surg Int,2015,31(11):1077 — 1085.DOI:10.1007/s00383 — 015 — 3762 — 4.
-
20 Large R J,Bradley E,Webb T,et al.Investigation of L-type Ca2+ current in the aganglionic bowel segment in Hirsch-sprung's disease[J].Neurogastroenterol Motil,2012,24(12):1126 — e571.DOI:10.1111/nmo.12006.
-
21 Kusafuka J,Kobayashi H,Miyahara K,et al.Does abnormal expression of acetylcholine receptors in Hirschsprung's disease induce acetylcholine esterase positive nerve fibres?[J].Asian J Surg,2007,30(4):255 — 260.DOI:10.1016/S1015 — 9584(08)60035 — 4.